Akuutit leukemiat
Akuutit leukemiat
ALL
ALL
| Kirjoittajat: | Erkki Elonen, Kimmo Porkka, Ulla Wartiovaara-Kautto |
| Viimeisin päivitys: | 8.10.2014 |
| ©Suomen Hematologiyhdistys | Suomen Leukemiaryhmä |
Diagnoosi
Diagnoosi
ALL-taudin diagnoosi perustuu luuytimen (tai veren) morfologiseen tutkimukseen, sekä blastien virtaussytometriseen pintaproteiinitutkimukseen, joita täydennetään myöhemmin valmistuvilla sytomolekyyligeneettisillä tutkimuksilla.
Diagnostiset kriteerit (WHO2008): blastien määrä veressä ja/tai luuytimessä ≥25% (poikkeus: tyyppitranslokaatiot).
Diagnoosivaiheen tutkimusten tulosten perusteella arvioidaan potilaan hoitokelpoisuutta, allogeenisen kantasolujensiirron mahdollisuutta, ennustetta, ja selvitetään minimitaudin (MRD) seurantaan sopivat merkkiaineet (markkerit).
Anamneesi
- Infektio, vuoto-oireet, tukosoireet, CNS-tautiin viittaavat oireet
- Luustokivut
- Verenvuototaipumus, verisuonitukostaipumus (sic! riskitekijät)
- Tuumoreihin viittaavat oireet
- Säteilyaltistus, aiemmat solunsalpaajahoidot, liuotinaine- ja torjunta ainealtistus
- Sairaudet, jotka voivat vaikuttaa intensiivisen induktiohoidon sietoon (sydän, maksa, munuaiset, diabetes, neurologia, psyyke)
- Lääkitys ja allergiat
- < 66-vuotiaiden potilaiden sisarusten olemassaolo, terveydentila ja kotipaikka selvitetään mah-dollista allogeenista kantasolujensiirtoa ajatellen.
Kiininen tutkimus
- Infektiofokukset (suu, ruoansulatuskanava, perianaaliseutu, hengitystiet, virtsatiet, iho)
- Imusolmukestatus, maksan ja pernan status, iho, neurologinen status
- Verenvuodot, viitteet trombooseista
Veri- ja virtsanäytteet
- B-PVK+TKD, E-Retik, veriryhmä (E-ABORh), ristikoe (B-Xkoe), P-CRP, P-TT, P-APTT, P-D-dimeer, P-fibrinogeeni, P-AT3, P-FVIII, P-Alb, S-Prot, S-IgA, S-IgG, S-IgM, P-Krea, P-K, P-Na, P-Ca-ion, P-Pi, P-Mg, P‑Gluc, P-Bilir, P-Bilir‑kj, P-ASAT, P-ALAT, P-LD, P-AFOS, P-Uraat, S-CMVAb, S-EBVAb, S-ToxoAb, S-HIVAgAb, S-HAVAb, S-HBsAg, S-HCVAb, B-HbA1c, (f)P-kol ja (f)P-trigly, U-seula ja U –BaktV, raskaustesti (tarvittaessa)
- HLA‑kudostyypitysnäyte I (SPR: tutkimusnumero 5306, B-potilaan HLA1-tutkimuspaketti (kantasolujensiirto)) ja HLA‑kudostyypitysnäyte II (SPR: tutkimusnumero 5357 "B-potilaan HLA2-näyte pakastettavaksi myöhempää tutkimustarvetta varten"). TÄRKEÄÄ: nämä näytteet otetaan kahtena eri päivänä, mielellään diagnoosipäivänä ja sitä seuraavana päivänä. Lisätiedot: SPR Veripalvelu
- Veren kromosomitutkimus otetaan varalle ja tutkitaan, jos epäillään synnynnäistä poikkeavuutta luuytimen kromosomitutkimuksen perusteella tai muusta syystä
Luuydinnäytteet
Aspiraationäyte
- Sivelyvalmiste: MGG‑ ja rautavärjäys.
- Leukeemisten blastien immunofenotyypitys
- Luuytimen hematologinen kromosomitutkimus ja tarvittaessa moniväri-FISH-tutkimus
- Luuytimen hematologinen fuusiogeeniseulonta
Potilaat, joita ei voida hoitaa remissioon tähtäävällä hoidolla
- Luuytimen sivelyvalmiste ja immunofenotyypitys
- Luuytimen kromosomitutkimus
- Luuytimen hematologinen fuusiogeeniseulonta
Biopsianäyte
- Jos aspiraattinäytettä ei saada, otetaan luuydinbiopsia. Palanen biopsiasta kromosomitutkimukseen.
ALL:n geneettinen diagnoosi, portaittainen strategia:
1. Välittömästi dg-vaiheen näytteestä:
- Fuus-mR: BCR-ABL, ETV6-RUNX1, TCF3-PBX1, KMT2A(MLL)-AF4, SIL-TAL1 (pos. tulos varmistetaan FISH:llä)
- FISH: ABL1, ABL2, CSF1R/PDGRFB, MLL, TCF3-HLF(ja TCF3-PBX1), iAMP21(ETV6-RUNX1)
- Bm-Kromos (tai SNP/CGH-arraytutkimus suoraan, jollei kromosomitutkimusta tehdä)
- MLPA- (tai array-) tekniikalla seuraavat: BTG1, CDKN2A/B, EBF1, ETV6, IKZF1, PAX5, RB1, PAR1
- ASOAL-D (potilasspesifisten ASO-PCR-alukkeiden haku)
2. Toisen linjan tutkimukset alkuvaiheen tulosten perusteella:
- Jos Bm-Kromos epäonnistuu tai karyotyyppi on normaali, tehdään SNP/CGH-arraytutkimus ploidia-tason selvittämiseksi
- Jos BCR-ABL posit.: herkkä T315I-mutaatioanalyysi
- Jos FISH:n perusteella MLL- (KMT2A) uudelleenjärjestymä, tehdään jatkotutkimuksena uudelleenjärjestymän sekvensointi DNA-tasolta (lähetys Frankfurtiin)
- Jos ETP-ALL:
- FLT3-D
- myelooinen NGS-paneeli - Erillisen pyynnön perusteela, jos epäillään harvinaista fuusiota (esim. Ph-like, CRLF2, PAX5, KMT2A): RNAMut
Biopankkinäytteet (FHRB) ja rekisteröintisuostumus
- Pt-hembio (HUS-piiri) kaikilta potilailta, sisältää sekä luuydin- että verinäytteitä. Ks. tarkemmin: hematology.fi/fhrb.
- Kaikilta potilailta tulee pyytää lupa tietojen tallentamiseen (FHRB-tiedote ja suostumus)
- Muistettava näytteet myös remissio- ja relapsivaiheessa
Likvori
- Diagnoosivaiheessa ainoastaan keskushermosto- ja aivohermo-oireisilta potilailta. (Trombosyyttien oltava >40 x 109/l lumbaalipunktiota tehtäessä. Jos potilaan veressä on blasteja, lumbaalipunktion tekemistä on harkittava likvorin kontaminaatioriskin takia, vaikka riski onkin melko pieni).
Kuvantamistutkimukset
- Keuhkokuva, vatsan UÄ, harkiten vartalon TT
Muut näytteet
- EKG
Luokitus
- Kirjaudu tai rekisteröidy kommentoidaksesi
Luokitus
ICD-O
ICD-O
WHO:n luokitus ja vastaava ICD-O –koodi (SHR-muuttuja: icd-o-all)
|
B-lymfoblastinen leukemia/lymfooma, muuten määrittämätön |
9811/3 |
|
B-lymfoblastinen leukemia/lymfooma, johon liittyy t(9;22)(q34;q11.2); BCR-ABL1 |
9812/3 |
|
B-lymfoblastinen leukemia/lymfooma, johon liittyy t(v;11q23); MLL:n uudelleenjärjestymä |
9813/3 |
|
B-lymfoblastinen leukemia/lymfooma, johon liittyy t(12;21)(p13;q22); TEL-AML1 (ETV6-RUNX1) |
9814/3 |
|
B-lymfoblastinen leukemia/lymfooma, johon liittyy hyperdiploidia |
9815/3 |
|
B-lymfoblastinen leukemia/lymfooma, johon liittyy hypodiploidia (hypodiploidi-ALL) |
9816/3 |
|
B-lymfoblastinen leukemia/lymfooma, johon liittyy t(5;14)(q31;q32); IL3-IGH |
9817/3 |
|
B-lymfoblastinen leukemia/lymfooma, johon liittyy t(1;19)(q23;p13.3); E2A-PBX1 (TCF3-PBX1) |
9818/3 |
|
Burkittin soluleukemia |
9826/3 |
|
T-lymfoblastileukemia/lymfooma |
9837/3 |
Riskiluokitus
- Kirjaudu tai rekisteröidy kommentoidaksesi
Riskiluokitus
Suuri riski
Diagnoosivaiheessa
- Philadelphia-kromosomi/BCR-ABL1-positiivinen ALL (jos hoidon aikana jäännöstautipositiivinen, ks. hoito-ohje)
- t(4;11), MLL-AF4, t(17;19), TCF3-HLF
- Varhainen T-solulinjan ALL (blastit CD1a–negatiivisia)
- Kypsäsoluinen T-solulinjan ALL (blastit CD1a-negatiivisia)
Hoidon aikana
- 1. induktiolla ei päästä sytologiseen remissioon
- Jäännöstauti >0,01% (>1x10-4) 2. konsolidaatiohoidon jälkeen (virtaussytometria/PCR)
- Lisääntyvä jäännöstauti (1,0 log suurentuma toistetusti 2 vkon sisällä/ molekyläärinen relapsi)
Standardi riski
Muut kuin suuren riskin taudit.
Seuranta ja vastearvio
Seuranta ja vastearvio
Diagnoosivaiheessa tehtyjen tutkimusten perusteella valitaan potilaskohtaiset seurantatutkimukset (sytogenetiikka, molekyyligenetiikka, immunofenotyypitys), mikäli sellaisia on olemassa. Joka vastearviokerralla tulisi määrittää vähintään oheiset avainmuuttujat.
Seurannan avainmuuttujat (SHR)
| Kuvaus | Lyhenne | |
| 1 | Taudin status (tilanne-/vastearvio) | status-al |
| 2 | Blastien prosenttiosuus sivelyvalmisteesta | bm-blast-p |
| 3 | Blastien sytogeneettinen poikkeavuus (G-raita, FISH; %), jos olemassa | tutkimuskohtainen |
| 4 | Blastien spesifi immunofenotyyppi (%), jos olemassa | bm-mrd-facs-p |
| 5 | Blastien spesifi genotyyppi (%), jos olemassa | tutkimuskohtainen |
Seuranta-ajankohdat
1. Hypoplasiavaiheen arviointi induktiohoidon jälkeen, päivä +14
- Aspiraationäytteen morfologia tutkitaan hypoplasian asteen ja leukemian refraktorisuuden arvioimiseksi. Toisinaan remissio tulee kuitenkin hitaasti eikä päivän 14 näytteen perusteella voida päätellä lopullista refraktorisuutta. Jos blasteja on ylimäärä, tutkitaan luuydin myös päivinä 21 ja 28, jotta mahdollinen reinduktio ei turhaan viivästyisi. Jos ensimmäisellä induktiohoidolla ei päästä remissioon, hypoplasiavaiheen näyte tutkitaan myös toisen induktiohoidon jälkeen.
2. Vasteen arviointi induktiohoidon jälkeen, päivä +28
Luuydinnäyte tutkitaan verenkuvan korjaannuttua hoidon jälkeen (b-neut >1,0, b-trom >100) tai viimeistään päivänä 28. Tämän löydöksen sekä soluarvojen perusteella päätetään seuraavan hoidon aloittamisesta.
- Aspiraationäytteen morfologinen tutkimus, josta lasketaan blastien prosenttiosuus
- Diagnoosivaiheessa määritetty potilaskohtainen jäännöstaudin markkeri(t), mikäli sellainen on olemassa
Jos luuydin on päivänä 28 vielä hypoplastinen ja veressä on merkittävä sytopenia, eikä seuraavaa solunsalpaajahoitoa voida aloittaa, luuytimen toipumista ja remission saavuttamista seurataan aspiraationäytteen morfologian avulla noin viikon välein.
3. Vasteen arviointi konsolidaatiohoitojen aikana
Luuydinnäyte tutkitaan verenkuvan korjaannuttua jokaisen konsolidaatiohoidon jälkeen (b-neut >1,0, b-trom >100) tai viimeistään päivänä 28. Tämän löydöksen sekä soluarvojen perusteella päätetään seuraavan hoidon aloittamisesta.
- Aspiraationäytteen morfologinen tutkimus, josta lasketaan blastien prosenttiosuus
- Diagnoosivaiheessa määritetty potilaskohtainen jäännöstaudin markkeri(t), mikäli sellainen on olemassa
- Likvoritutkimukset tehdään hoito-ohjelman mukaisesti siten, että jokaisella lumbaalipunktiokerralla otetaan Li-solut ja Li-blastit -tutkimukset sekä erillisen harkinnan mukaan myös virtaussytometrinen solujen pintaproteiinianalyysi.
4. Vasteen arviointi konsolidaatiohoitojen päättymisen jälkeen
Granulosytopenian, trombosytopenian tai anemian kehittyminen tai paheneminen voivat viitata relapsiin ja ne samoin kuin blastien ilmaantuminen vereen, indisoivat luuytimen aspiraationäytteen tutkimisen. Erityisen tiiviisti on syytä seurata niitä potilaita, joiden relapsivaiheen hoidossa kantasolujensiirto voi tulla kyseeseen. Jos aiemmin jäännöstaudin suhteen negatiivisella potilaalla todetaan positiivinen tulos, ohjelmoidaan uusi näyte mahdollisimman pian. Merkittävän jäännöstaudin ilmaantuminen voi johtaa uusiin hoitoihin, allogeeniseen kantasolusiirtoon tai siirron jo saaneilla aikaistettuun immunosuppression purkuun ja lymfosyyttisiirtoon kantasolujen luovuttajalta (DLI).
Seurantaohjelma
1. vuosi konsolidaatiohoidon päättymisestä
- 1 kk välein B-PVK+TKD
- 3kk välein luuydinnäyte
- morfologia
- jäännöstauti (RQ-PCR ja tai FCM-menetelmällä)
2. vuosi konsolidaatiohoidon päättymisestä
- 3 kk välein B-PVK+TKD
- 3 kk välein luuytimen aspiraationäyte3kk välein luuydinnäyte
- morfologia
- jäännöstauti (RQ-PCR ja tai FCM-menetelmällä)
3.-4. vuosi (5 vuoteen saakka) konsolidaatiohoidon päättymisestä
- 4-6 kk välein PVK+TKD
- Luuytimen aspiraatiotutkimus tehdään, jos soluarvot tai oireet antavat siihen aihetta
Tutkimukset epäiltäessä relapsia
Granulosytopenian, trombosytopenian tai anemian kehittyminen tai paheneminen voivat viitata relapsiin ja ne samoin kuin blastien ilmaantuminen vereen, indisoivat luuytimen aspiraationäytteen tutkimisen. Erityisen tiiviisti on syytä seurata niitä potilaita, joiden relapsivaiheen hoidossa kantasolujensiirto voi tulla kyseeseen. ALL-potilaita seurattaessa on huomattava, että relapsi voi esiintyä myös pelkästään keskushermostossa.
Anamneesi:vuototaipumus, infektio, yleisoireet, kivut, päänsärky, pahoinvointi
Status:petekiat, mustelmat, infektiofokukset, hepatosplenomegalia, lymfadenopatia, tuumorit, iho, aivohermojen löydökset
Veri- ja virtsakokeet:B-PVK+TDK, CRP, P-Krea, P-K, P-Na, P-Bilir, P-ALAT, P-AFOS, P-TT, P‑Gluk, P-Alb, P-LD, P-Ca-ion, P-Pi, P-Mg, P-Uraat, B-Xkoe
Luuytimen aspiraationäyte, josta vähintään:
- MGG‑värjäys
- Kromosomitutkimus harkinnan mukaan
- Pintamerkkitutkimus harkinnan mukaan
- Jäännöstaudin seurantamarkkeri harkinnan mukaan
Relapsin määritelmä ja hoitoindikaatio:
- Molekyläärinen/immunofenotyyppien relapsi
- Morfologinen relapsi
Taudin status
- Kirjaudu tai rekisteröidy kommentoidaksesi
Taudin status
Vastearvion yhteydessä pyritään tautitaakan arvio ja taudin tilanne luokittelemaan oheisen taulukon mukaisesti (SHR-muuttuja: status-al). Taulukosta valitaan arviointihetkellä oleva paras vaste.
|
Koodi |
Lyhenne |
Nimike |
Määritelmä |
|
1 |
CR-MRDneg |
Remissio, jäännostauti negatiivinen |
|
|
2 |
CR-MRDpos |
Remissio, jäännostauti positiivinen |
|
|
3 |
CCR |
Sytogeneettinen remissio |
|
|
4 |
CR |
Morfologinen remissio |
|
|
5 |
CRi |
Remissio, puutteellinen luuytimen toipuminen |
|
|
6 |
PR |
Osittainen remissio |
|
|
7 |
Hypoplasia |
Dysplasia/hypoplasia |
|
|
8 |
RD |
Refraktaari tauti (RD) |
|
|
12 |
Relapsi (MRD) |
Molekyyligenettinen relapsi |
|
|
9 |
Relapsi (bm) |
Relapsi |
|
| 10 |
Relapsi (neuro) |
Isololoitu neurorelapsi |
|
| 11 |
Relapsi (ekstram) |
Isololoitu ekstramedullaarinen relapsi |
|
|
90 |
Exitus-relapsi |
Exitus, relapsi |
|
|
91 |
Exitus-infektio |
Exitus, infektio |
|
|
92 |
Exitus-aplasia |
Exitus, aplasia |
|
|
93 |
Exitus-muu tauti |
Exitus toisesta taudista johtuen |
|
| 98 | Exitus - ei hoitoa | Exitus, hoitoon ei mahdollisuutta | |
|
99 |
Exitus-tuntematon |
Exitus, syy tuntematon |
|
|
999 |
Poistunut seurannasta |
Seuranta loppunut (lost-to-follow-up) |
|
Hoito
Hoito
ALL-potilaat hoidetaan kunkin hoitoyksikön hoitolinjan mukaisesti
Helsingissä 16-45 –vuotiaat hoito-ohjelmaan soveltuvat potilaat saavat ensisijaisesti NOPHO-ALL2008-tutkimuksen mukaista hoitoa. Yli 45-vuotiaille tai NOPHO-ohjelmaan soveltumattomille käytetään ALL2000_amendement_2014 – hoito-ohjelmaa. BCR-ABL1/Ph–positiiviset ALL-taudit hoidetaan samoin periaattein siten, että heti kun tieto fuusiogeenistä on saatu, hoitoon liitetään dasatinibi 140 mg x1 2 viikon ajaksi, minkä jälkeen dasatinibin annos pienenee ad 100 mg x1 (ks. tarkempi ohje).
Ensilinjan hoito
Vaihtoehtoja:
- ALL2000_Amendment2014
- NOPHO ALL-2008 -tutkimushoito-ohjelma (TVH dos. Ulla Wartiovaara-Kautto/HYKS Syöpäkeskus)
- BCR-ABL1/Ph+ ALL-hoito-ohje
Refraktaarin taudin tai relapsivaiheen hoito
-
Jos tauti on refraktaari induktiohoidoille tai relapsoituu, pyritään tutkimukselliseen tai modifioituun hoitoon ja allogeeniseen kantasolusiirtoon
Mahdollisia hoitoja ovat mm.
- Tutkimushoito
- Klofarabiini-sytarabiini-etoposidi -hoito
- Nelarabiini (T-ALL)
- NOPHO ALL-2008 - blokkihoidot
- ALL2000_amendmentin konsolidaatiohoidot
Ph-positiivinen ALL
- Kirjaudu tai rekisteröidy kommentoidaksesi
Ph-positiivinen ALL
BCR-ABL1/Ph–positiiviset ALL-taudit hoidetaan joko ALL2000_amendment_2014 -hoito-ohjelman tai NOPHO-ALL2008 (induktiohoito non-HR) tutkimuksen protokollan (ei tutkimuspotilaana) mukaisesti siten, että heti kun tieto fuusiogeenistä on saatu, hoitoon liitetään tyrosiinikinaasiestäjä (TKE, dasatinibi 140 mg x1 2-4 viikon ajaksi, minkä jälkeen dasatinibin annos pienenee ad 100 mg x1, mikäli saavutettu vähintään hematologinen remissio).
TKE jatkuu vähintään ylläpitohoidon loppuun, jolloin se voidaan lopettaa, jos jäännöstautia ei ole todettavissa (MRD-negatiivinen). Allogeenisen siirron jälkeen TKE-lääkitys jatkuu 2 vuotta siirrosta. Dasatinibin tilalla voidaan myös käyttää imatinibia 600-800 mg/vrk; dasatinibin etuna on hyvä CNS-penetraatio, laajempi kinaasiestospektri ja siedettävyys, haittana pleuraeffuusioriski. Peruskorvattavuuden saamiseksi ensilinjan hoitona tulisi dasatinibia koskevaan B-lausuntoon lisätä maininta dasatinibin eduista imatinibi-lääkitykseen nähden (ks. templaattiteksti).
Ponatinibista on saatu viime vuosina hyviä alustavia hoitotuloksia yhdistettynä intensiiviseen solunsalpaajahoitoon (CVAD)(viite). Samoin blinatumomabi on tulossa myös Ph+ALL-taudin hoitoon (viite).
Allogeenista kantasolujensiirtoa harkitaan ensimmäisessä remissiossa potilailla, jotka täyttävät allogeenisen siirron soveltuvuuskriteerit. Tautitaakka tulisi olla mahdollisimman pieni ennen allogeenista siirtoa (MRD mielellään <0,01%).
HUS-hoito-ohje kevät 2017: Allogeenista kantasolujensiirtoa harkitaan potilailla, joilla hoidon jälkeen on merkittävä jäännöstauti (ALL2000_amend 1. kons.hoidon jälkeen MRD>0,01%; NOPHO-ALL2008 >5% d29, >0,01% d79; BCR-ABL1 RQ-PCR). Näiden aikapisteiden jälkeen allogeenista kantasolujensiirtoa harkitaan myös potilailla, joilla jäännöstauti jää tai muuttuu mitattavaksi (MRDpos).
Vanhemmilla tai huonokuntoisilla potilailla voidaan harkita myös dasatinibi-induktiohoitoa monoterapiana (tai deksametasonipulssihoitoon yhdistettynä), jolloin annos on 140 mg x1 kahden viikon ajan, minkä jälkeen 100 mg x1. Konsolidaatiohoitoon tulisi näilläkin potilailla dasatinibin oheen liittää solunsalpaajahoito dasatinibi-resistenttien kloonien ekspansion estämiseksi, esimerkiksi redusoituna ALL2000_amend2014-hoitoja ilman asparaginaasia ja it-hoitoja (jos TKE on dasatinibi).
Dasatinibin B-lausunto
- Kirjaudu tai rekisteröidy kommentoidaksesi
Dasatinibin B-lausunto
Dasatinibin peruskorvattavuutta koskevaan B-lausuntoon tulisi liittää maininta miksi imatinibi ei ole soveltuva lääke Ph+ALL-taudin hoidossa. Asiasta keskusteltu Kelan kanssa marraskuussa 2015. Esimerkki B-lausuntoon liitettävästä templaattitekstistä:
"Ph-positiivinen ALL on suuren riskin akuutti leukemia, jonka hoidossa on tärkeää tautitaakan nopea pienentäminen ja keskushermostotaudin tehokas esto ja hoito. Siksi imatinibi ei ole optimaalinen lääke, koska se ei läpäise veri-aivoestettä ja sen kinaasiestokirjo on kapea. Lisäksi suurella annoksella imatinibin siedettävyys on huonoa. Dasatinibi läpäisee veri-aivoesteen ja on osoitetusti tehokas neuroleukemian hoidossa. Sen kinaasiestokirjo on laaja, mikä on edullista korkean riskin taudin hoidossa. Lisäksi lääke on hyvin siedetty."
Kantasolujensiirto
Kantasolujensiirto
Allogeenista kantasolujensiirtoa harkitaan suuren relapsiriskin potilailla. Toisin kuin AML-taudissa, suurin osa potilaista voidaan hoitaa kemoterapialla ilman allogeenista kantasolujensiirtoa.
Tutkimuksia
- Kirjaudu tai rekisteröidy kommentoidaksesi
Tutkimuksia
ALL2000 (ensilinja)
ALL2000 (ensilinja)
Potilaan suostumus
Ennen hoidon aloittamista potilaalta pyydetään kirjallinen suostumus tutkimukseen osallistumisesta (liitetiedosto tämän sivun alalaidassa).
Yleistä
Hoidot 1–6 pyritään antamaan mahdollisimman nopeasti sen jälkeen, kun solut ovat toipuneet edellisestä hoidosta (B‑neutr ³1,0 x 109/l, B-tromb ³50 x 109/l). Solunsalpaajahoitoa aloitettaessa väliajan edelliseen G-CSF-hoitoon on oltava 72 t ja HD‑metotreksaattiin 7 pv. Jos kolmella hoidolla ei saavuteta remissiota, induktiohoito katsotaan epäonnistuneeksi ja jatkohoito on hoitavan lääkärin vapaasti valittavissa. Induktio- ja konsolidaatiohoitoja seuraa ylläpitohoito, joka jatkuu 3 vuoteen saakka diagnoosista.
Hoito 1
Suomen Leukemiaryhmän Akuutti leukemia -työryhmän kokouksessa 13.02.2013 päätettiin, ettei MEA vs. CVAD -satunnaistamista enää jatketa vaan kaikki potilaat saavat CVAD-induktiohoidon.
Hoito1, CVAD
Syklofosfamidi
300 mg/m2 x 2 30 minuutin infuusiona päivinä 1 - 3, yhteensä 6 annosta
Vinkristiini
1,4 mg/m2 (max 2 mg) nopeana infuusiona päivinä 4 ja 11, yhteensä 2 annosta
Doksorubisiini
50 mg/m2 30 min infuusiona päivänä 4.
Deksametasoni
20 mg/m2 po. päivinä 1 ‑ 4 ja 11 ‑ 14.
It. metotreksaatti
12,5 mg päivänä 8 (± 1 päivä), (trombosyyttiensiirto tarvittaessa niin, että B-tromb on yli 40 x 109/l). Huom! Tämä it.-hoito annetaan vain, kun CVAD on ensimmäisenä induktiohoitona.
It. sytarabiini
75 mg päivänä 22 (jos B-tromb yli 40 x 109/l).
It. metotreksaatti
12,5 mg päivänä 23 (jos B-tromb yli 40 x 109/l).
Huom!
Kun CVAD-hoito annetaan toisena hoitona (ks. alla), it. metotreksaattia ei anneta päivänä 8.
Päivien 22 ja 23 it.‑hoidot voidaan antaa aikaisemmin, jos trombosyytit ovat yli 40 x 109 tai ne annetaan myöhemmin, jos vaikea trombosytopenia vielä jatkuu yllämainittuina päivinä.
Jos virtsarakon seutuun on annettu sädehoitoa tai rakon limakalvo muutoin on vaurioitunut, syklofosfamidihoidon päivinä voidaan antaa mesnaa 600 mg/m2/vrk jatkuvana infuusiona.
Hoito 2
CVAD-hoito yllä esitetyn mukaisesti. It. metotreksaattia ei anneta päivänä 8.
Jos edellisestä hoidosta tuli virtsarakkovaivoja, syklofosfamidihoidon päivinä annetaan mesnaa 600 mg/m2/vrk jatkuvana infuusiona.
Hoito 3
Daunorubisiini
16‑55‑vuotiaat potilaat: 60 mg/m2 30 min infuusiona päivinä 1, 3 ja 5.
56‑65‑vuotiaat potilaat: 45 mg/m2 päivinä 1, 3, ja 5.
Vinkristiini
1,4 mg/m2 (max 2 mg) nopeana infuusiona päivinä 1 ja 8 sekä 0,4 mg/potilas/vrk jatkuvana infuusiona päivinä 15 ‑ 18 (4 vrk ajan).
Deksametasoni
20 mg/m2 po. päivinä 1 ‑ 4 ja 11 ‑ 14.
Asparaginaasi
Alle 56‑vuotaat potilaat 6000 yks/m2 ja 56 vuotta täyttäneet potilaat 4000 yks/m2 30 minuutin inf. päivinä 8, 11, 15, 18 ja 22.
It. sytarabiini
75 mg päivänä 22 (tai heti, kun B-tromb ovat yli 40 x 109/l).
Hoito 4
It. metotreksaatti
12,5 mg päivinä 1 ja 15.
Metotreksaatti
600 mg/m2 1 tunnin infuusiona ja 2400 mg/m2 23 tunnin infuusiona päivinä 1 ja 15 yhteensä 2 annosta.
Kalsiumfolinaatti
Kalsiumfolinaatti aloitetaan päivänä 2 ja päivänä 16, 30 tunnin kuluttua metotreksaatti‑infuusion alusta ja sitä annetaan po. tai iv. 5 annosta á 30 mg 4 tunnin välein. Sen jälkeen kalsiumfolinaattia annetaan po. 15 mg x 4 kahden vuorokauden ajan. Lisäksi kalsiumfolinaattia annetaan imeskeltäväksi ½ tablettia samoina ajankohtina. Virtsan alkalisoinnista on huolehdittava.
Ks Hematologinen kansio/Solunsalpaajiin liittyviä ohjeita/Metotreksaatti
Deksametasoni
20 mg/m2 po. päivinä 2 ‑ 5 ja päivinä 16 - 19
Vinkristiini
1,4 mg/m2 (max 2,0 mg/potilas) inf. päivinä 3 ja 17
Merkaptopuriini
60 mg/m2 po. päivinä 4 ‑ 13 (10 annosta) ja 18 - 25, yhteensä 8 annosta.
Jos päiväksi 15 suunniteltua metotreksaattihoitoa joudutaan siirtämään fulminantin infektion, vaikean mukosiitin tai vaikean neutropenian takia, kaikki päivien 15 ‑ 25 hoidot (metotreksaatti, kalsiumfolinaatti, vinkristiini, merkaptopuriini ja deksametasoni) siirtyvät blokkina yhtä monta päivää myöhäisemmiksi.
Hoito 5 pyritään aloittamaan päivänä 29.
Hoito 5
Doksorubisiini
30 mg/m2 30 minuutin infuusiona päivinä 1, 8 ja 15.
Vinkristiini
1,2 mg/m2 (max 2 mg/potilas) nopeana infuusiona päivinä 1, 8 ja 15.
Deksametasoni
10 mg/m2 po. päivinä 1 ‑ 14, minkä jälkeen deksametasoni lopetetaan viikon kuluessa.
It. sytarabiini
75 mg päivänä 1.
It. metotreksaatti
12,5 mg päivänä 2.
Syklofosfamidi
1000 mg/m2 30 minuutin inf. päivänä 29.
Tioguaniini
60 mg/m2 po. päivinä 29 - 42.
Sytarabiini
75 mg/m2 sc. päivinä 29-32 ja 36-39.
Hoito 6
Metotreksaatti
200 mg/m2 yhden tunnin infuusiona ja 800 mg/m2 23 tunnin infuusiona päivänä 1.
Kalsiumfolinaatti
Kalsiumfolinaattihoito aloitetaan 48 tunnin kuluttua metotreksaatti-infuusion alusta. Kerta-annoksena annetaan 50 mg po. ja sen jälkeen annetaan kuuden tunnin välein 15 mg po. kahdeksan annosta.
Ks Hematologinen kansio/Solunsalpaajiin liittyviä ohjeita/Metotreksaatti
Sytarabiini
Sytarabiinia annetaan kahden tunnin infuusiona 12 tunnin välein päivinä 2 ja 3, yhteensä 4 annosta.
16‑55‑vuotiaat potilaat: kukin kerta-annos on 3000 mg/m2 .
56‑65‑vuotiaat potilaat: kukin kerta-annos on 1000 mg/m2 .
Jos kreatiniinin tai alkalisen fosfataasin arvo on koholla, sytarabiinin annos on korkeintaan 1000 mg/m2.
Kortikosteroidisilmätipat
1 gtt kumpaankin silmään x 4 päivinä 2 ja 3.
CNS-profylaksi induktio- ja konsolidaatiohoitojen aikana
Intratekaalisesti annetaan sytarabiinia 75 mg ja metotreksaattia 12,5 mg hoito‑ohjelman mukaisina päivinä, edellyttäen että trombosyyttiarvo on yli 40 x 109/l. Lisäksi annetaan HD‑metotreksaatti- ja HD-sytarabiinihoitoa.
Sädehoito
Mediastinumin sädehoito
Mediastinumin sädehoito annetaan remissioon päästyä kaikille potilaille, joilla diagnoosin aikaan thorax‑kuvan perusteella on ollut osoitettavissa mediastinumin tuumori. Erityisesti T‑ALL:ssa mediastinumtuumori on tavallinen, mutta se voi esiintyä myös B‑solulinjan ALL:ssa.
Muiden tuumorialueiden sädehoito
Tuumorialueen sädehoito annetaan remissioon päästyä kaikille potilaille, joilla diagnoosin aikaan on todettu yli 5 cm läpimittainen tuumori.
Testisten sädehoito
Testisten sädehoito 24 Gy annetaan niille potilaille, joille testisleukemiaepäilyn takia on tehty biopsia ja todettu testiksen leukeeminen infiltraatio.
Kantasolujensiirtopotilaat
Jos allogeeninen kantasolujensiirto voi tulla kyseeseen, on syytä neuvotella siirtokeskuksen kanssa ennen sädehoidon antamista.
Ylläpitohoito
Ylläpitohoito aloitetaan heti solujen toivuttua hoidosta 6 ja sitä jatketaan kunnes diagnoosipäivästä on kulunut 3 vuotta tai ilmaantuu relapsi. Ylläpitohoidon annoksia lisätään tai vähennetään siten, että veren leukosyyttien määrä pysyttelee 3,0 x 109/l tienoilla ja neutrofiilien määrä yli 1,0 x 109/l. Relapsien välttämiseksi on tärkeää pyrkiä tehokkaaseen ylläpitohoitoon.
Merkaptopuriini
60 mg/m2 x 1 po. päivittäin.
Metotreksaatti
20 mg/m2 po. yhtenä annoksena kerran viikossa.
Vinkristiini
1,4 mg/m2 (max 2 mg/potilas) nopeana infuusiona neljän viikon välein edellisen hoidon alusta seuraavan hoidon alkuun laskettuna. Vinkristiinihoito jatkuu 12 kk:n ajan. Jos potilaalla on merkittävä neuropatia, vinkristiini jätetään antamatta.
Prednisoni
60 mg/m2 po. viiden päivän ajan neljän viikon välein edellisen hoidon alusta seuraavan hoidon alkuun laskettuna. Hoito jatkuu 12 kk:n ajan.
CNS‑profylaksi ylläpitohoidon aikana
CNS‑profylaksina annetaan metotreksaattia 12,5 mg it. suuren riskin potilaille 6 kertaa ja muille potilaille 3 kertaa.
Suuren riskin potilaat
Jos potilaalla on diagnoosivaiheessa
1) LD yli 1175 U/l (5 x normaalin yläraja)
2) B-leuk yli 50 x 109/l tai
3) ekstramedullaarisia infiltraatioita muualla kuin pernassa, maksassa tai imusolmukkeissa
it. hoitoja annetaan yhteensä kuusi kertaa 4 viikon välein.
Potilaat, joilla ei ole suuren riskin tekijöitä diagnoosivaiheessa
Jos potilaalla ei ole edellä mainittuja neuroleukemian riskitekijöitä, it.-hoitoja annetaan yhteensä kolme kertaa 8 viikon välein
AML
AML
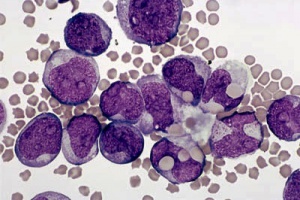 Akuutti myelooinen leukemia (AML) ryhmä geneettisesti erilaisia veritauteja, joiden yhteisenä piirteenä on kypsymishäiriö ja hallitsematon kasvu luuytimen myelooisissa progenitori- ja kantasoluissa. AML:n diagnoosi perustuu luuytimen (tai veren) morfologiaan ja leukemiaspesifisien pintaproteiinien ja sytomolekylaaristen poikkeavuuksien osoittamiseen.
Akuutti myelooinen leukemia (AML) ryhmä geneettisesti erilaisia veritauteja, joiden yhteisenä piirteenä on kypsymishäiriö ja hallitsematon kasvu luuytimen myelooisissa progenitori- ja kantasoluissa. AML:n diagnoosi perustuu luuytimen (tai veren) morfologiaan ja leukemiaspesifisien pintaproteiinien ja sytomolekylaaristen poikkeavuuksien osoittamiseen.
AML-tautia hoidetaan monisolunsalpaajahoidolla ja osalla potilaista hoitoa tehostetaan allogeenisen kantasolujensiirron avulla. Hoito perustuu Suomen Leukemiaryhmän AML-2012 hoito-ohjelmaan niillä potilailla, joille voidaan antaa intensiivistä, remissioon tähtäävää solunsalpaajahoitoa. Muilla potilailla hoidon aiheet ja laatu punnitaan potilaskohtaisesti.
Sivuto on siirtymässä toiseen osoitteeseen. Voimassa olevat ohjeet löytyvät: https://www.hematology.fi/fi/hoito-ohjeet/veritaudit/akuutit-leukemiat/a...
| Toimitus | Pirjo Koistinen, Kimmo Porkka, Erkki Elonen, Mika Kontro, Riikka Räty |
Diagnoosi
Diagnoosi
Sivusto siirtymässä toiseen osoitteseen. Ajankohtaiset ohjeet löytyvät toistaiseksi linkistä: https://www.hematology.fi/fi/hoito-ohjeet/veritaudit/akuutit-leukemiat/a...
AML-taudin diagnoosi perustuu luuytimen (tai veren) morfologiseen tutkimukseen, sekä blastien virtaussytometriseen pintaproteiinitutkimukseen, joita täydennetään myöhemmin valmistuvilla sytomolekyyligeneettisillä tutkimuksilla.
Diagnostiset kriteerit (WHO2008): blastien määrä veressä ja/tai luuytimessä >=20% (tarkennukset).
Diagnoosivaiheen tutkimusten tulosten perusteella arvioidaan potilaan hoitokelpoisuutta, allogeenisen kantasolujensiirron mahdollisuutta, ennustetta ja selvitetään minimitaudin (MRD) seurantaan sopivat merkkiaineet (markkerit).
Anamneesi
- infektio‑ ja vuoto-oireet
- luustokivut
- tuumoreihin viittaavat oireet
- säteilyaltistus, aiemmat solunsalpaajahoidot, liuotinaine- ja torjunta‑ainealtistus
- sairaudet, jotka voivat vaikuttaa intensiivisen induktiohoidon sietoon (sydän, maksa, munuaiset, diabetes, neurologia, psyyke)
- lääkitys ja allergiat
- alle 66‑vuotiaiden potilaiden sisarusten olemassaolo, terveydentila ja kotipaikka selvitetään mahdollista allogeenista kantasolujensiirtoa ajatellen.
Kliininen tutkimus
- infektiofokukset (suu, ruoansulatuskanava, perianaaliseutu, hengitystiet, virtsatiet, iho)
- verenvuototaipumus
- imusolmukestatus, maksan ja pernan status, ihoinfiltraatiot ja ienhyperplasia.
Veri- ja virtsanäytteet
- B-PVK+TKD, E-Retik, veriryhmä (E-ABORh), ristikoe (B-Xkoe), P-CRP, P-TT, P-APTT, P-D-dimeer, P-fibrinogeeni, P-Alb, S-Prot, S-IgA, S-IgG, S-IgM, P-Krea, P-K, P-Na, P-Ca-ion, P-Pi, P-Mg, P‑Gluc, P-Bilir, P-Bilir‑kj, P-ASAT, P-ALAT, P-LD, P-AFOS, P-Uraat, S-CMVAb, S-EBVAb, S-ToxoAb, S-HIVAgAb, S-HAVAb, S-HBsAg, S-HCVAb, B-HbA1c, (f)P-kol ja (f)P-trigly, U-seula ja U –BaktV, raskaustesti (tarvittaessa).
- 8 ml verta CPT-putkeen molekyyligeneettisiä tutkimuksia varten (TyksLab)
- HLA‑kudostyypitysnäyte I (SPR: tutkimusnumero 5306, B-potilaan HLA1-tutkimuspaketti (kantasolujensiirto)) ja HLA‑kudostyypitysnäyte II (SPR: tutkimusnumero 5357 "B-potilaan HLA2-näyte pakastettavaksi myöhempää tutkimustarvetta varten"). TÄRKEÄÄ: nämä näytteet otetaan kahtena eri päivänä, mielellään diagnoosipäivänä ja sitä seuraavana päivänä. Lisätiedot: SPR Veripalvelu
Luuydinnäytteet
Aspiraationäyte
- Sivelyvalmiste: MGG‑, ANAE‑ ja rautavärjäykset.
- Leukeemisten blastien immunofenotyypitys
- Luuytimen hematologinen kromosomitutkimus ja tarvittaessa moniväri-FISH-tutkimus
- Luuytimen hematologinen fuusiogeeniseulonta
- FISH-seulonta: EVI, MLL ja kromosomien 5 ja 7 deleetiot (5q31, 7q31, kr. 7 sentromeeri)(vain TaYS ja TYKS)
- FLT3-geenin mutaatiotutkimus ja nukleofosmiinigeenin (NPM1) mutaatiotutkimus
- CEBPA-geenin mutaatiotutkimus; ainoastaan potilailla, joilla ei muita markkereita (normaali sytogenetiikka, ei FLT3- tai NPM1-mutaatioita)
- NUP98-NSD1-fuusiogeenitutkimus (fuusiogeeniseula II, TYKS)
- TyksLabiin lähetettävät molekyyligeneettiset näytteet otetaan kahteen 4ml:n CPT-putkeen
- Molekyyligeneettisten tutkimusten porrastus (TYKS)
70 vuotta täyttäneet sekä potilaat joita ei voida hoitaa remissioon tähtäävällä hoidolla
- luuytimen sivelyvalmiste ja immunofenotyypitys
- luuytimen kromosomitutkimus
Biopsianäyte
-
Jos aspiraattinäytettä ei saada niin otetaan luuydinbiopsia. Palanen biopsiasta kromosomitutkimukseen.
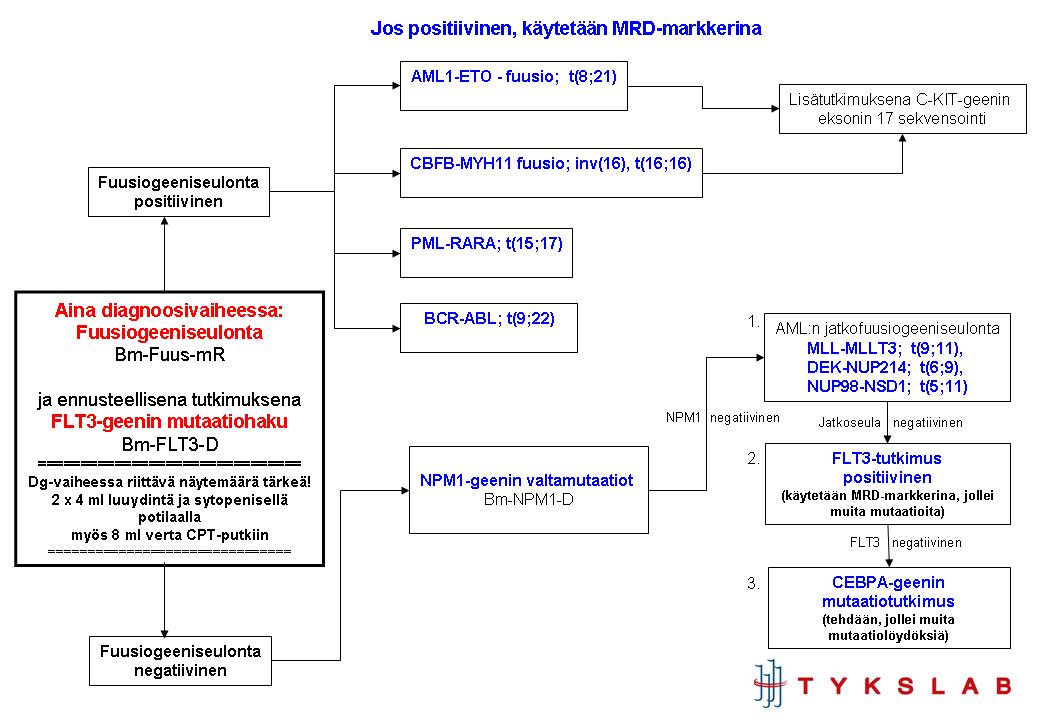
AML:n geneettinen diagnoosi, portaittainen strategia:
1. Välittömästi dg-vaiheen näytteestä:
- FISH: 5q-, 7q-, EVI1, TP53del, MLL
- Bm-Kromos: (tarv. varmistetaan FISH:llä)
- Fuus-mR: (pos. löydös varmistus FISHillä) PML-RARA, CBFB-MYH11, RUNX1-RUNX1T1, BCR-ABL
- FLT3-D
- Myeloinen NGS-paneeli (sis. NPM1, KIT ym.)
2. Mikäli Fuu-mR negatiivinen:
- Fuus2-mR:MLL-MLLT3, DEK-NUP214, NUP98-NSD1
3. Erillisestä pyynnöstä, kun sytogenetiikan perusteella epäily fuusiogeenistä tai mikäli Fuus-mR, NPM1 ja Fuus2-mR kaikki negatiivisia:
- RNAMut
- Erillisen pyynnön perusteella, mikäli ei huonon ennusteen löydöksiä: CEBPA-geenin
mutaatioanalyysi
Biopankkinäytteet (FHRB) ja rekisteröintisuostumus
- Pt-hembio (HUS-piiri) kaikilta potilailta, sisältää sekä luuydin- että verinäytteitä. Ks. tarkemmin: hematology.fi/fhrb
- Kaikilta AML-2012-hoito-ohjelmaan osallistuvilta (miel. myös muilta) potilailta tulee pyytää lupa tietojen tallentamiseen (FHRB-tiedote ja suostumus)
Likvori
- Ainoastaan keskushermosto‑ ja aivohermo‑oireisilta potilailta
- Suuren riskin potilailta remissioon päästyä
Trombosyyttien on oltava >40 x 109/l lumbaalipunktiota tehtäessä. Jos potilaan veressä on blasteja, lumbaalipunktion tekemistä on harkittava likvorin kontaminaatioriskin takia, vaika riski onkin melko pieni.
Kuvantamistutkimukset
- Keuhkokuva, vatsan UÄ, harkiten vartalon TT-kuvaus
Muut näytteet
- EKG
Molekyyligeneettisten tutkimusten porrastus (TYKSLAB), päivitys kesken
- Kirjaudu tai rekisteröidy kommentoidaksesi
Molekyyligeneettisten tutkimusten porrastus (TYKSLAB), päivitys kesken
Luokitus
- Kirjaudu tai rekisteröidy kommentoidaksesi
Luokitus
Sivusto siirtymässä toiseen osoitoitteseen. Ajankohtaiset ohjeet löytyvät toistaiseksi linkistä: https://www.hematology.fi/fi/hoito-ohjeet/veritaudit/akuutit-leukemiat/a...
ELN 2017 riskiluokitus
ELN 2017 riskiluokitus
AML-2018 -protokollan geneettinen riskiluokitus on seuraavanlainen (perustuu European LeukemiaNetin suositukseen v. 2017):
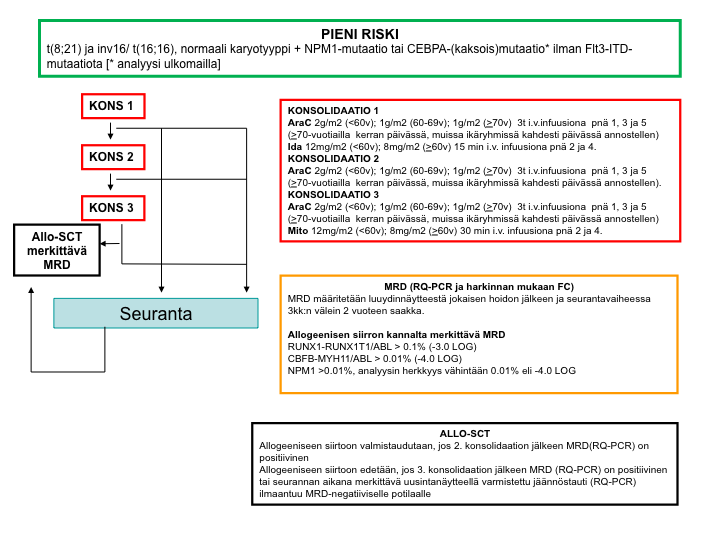
Pieni riski (ryhmä I)
Seuraavat karyotyyppipoikkeavuudet (yksin tai muiden poikkeavuuksien yhteydessä)
- t(8;21) (q22;q22.1) [ RUNX1-RUNX1T1]
- inv16 (p13.1q22)/t(16;16) (p13.1;q22) [CBFB-MYH11]
- NPM1-mutaatio ilman Flt3-ITD-mutaatiota tai kun Flt3-ITD-alleelikuorma on matala (<0,5)
- kaksoismutatoitunut CEBPA ilman Flt3-ITD-mutaatiota
Keskiriski (Ryhmä II)
Ei korkean riskin karyotyyppimuutoksia tai mutaatioita seuraavien mutaatioiden yhteydessä:
- Korkean alleelikuorman (>0,5) FLT3-ITD-mutaatio ja NPM1-mutaatio
- Matalan alleelikuorman (<0,5) FLT3-ITD-mutaatio ilman NPM1-mutaatiota
Normaali karyotyyppi ilman FLT3-ITD- ja NPM1-mutaatioita
Seuraavat ryhmiin I ja III kuulumattomat karyotyyppipoikkeavuudet
- t(9;11)(p21.3;q23.3) [MLLT3-KMT2A]
Muut ryhmään I ja III kuulumattomat karyotyyppipoikkeavuudet
Suuri riski (Ryhmä III)
Seuraavat karyotyyppipoikkeavuudet
- t(6;9)(p23;q34.1) [DEK-NUP214]
- t(v;11q23.3) [uudelleenjärjestäytynyt KMT2A luk.ottamatta muutosta t(9;11)]
- t(9;22)(q34.1;q11.2) [BCR-ABL1]
- inv(3)(q21.3q26.2) / t(3;3)(q21.3;q26.2) [GATA2, MECOM(EVI1)]
- -5, 5q-, -7, -17/poikkeava 17p
- kompleksinen karyotyyppi (kolme tai useampi karyotyyppipoikkeavuus. Lukuun ei lasketa: t(15;17), t(8;21), inv(16), t(16;16), t(9;11), t(v;11)(v;q23.3), t(6;9), inv(3), t(3;3), BCR-ABL1)
- monosomaalinen karyotyyppi (yksi autosomin monosomia + yksi tai useampi rakenteellinen karyotyyppipoikkeavuus; kaksi tai useampi autosomin monosomiapoikkeavuutta)
Huom! Pienen riskin karyotyyppipoikkeavuuksia ja XY monosomioita ei lasketa mukaan
Seuraavat korkean riskin mutaatiot
- korkean alleelikuorman (>0,5) Flt3-ITD -mutaatio ilman NPM1-mutaatiota
- RUNX1 -mutaatio (ei pienen riskin muutoksiin yhdistyneenä)
- ASXL1 -mutaatio (ei pienen riskin muutoksiin yhdistyneenä)
- TP53 -mutaatio (esiintyy yleensä kompleksisen tai monosomaalisen karyotyypin kanssa)
ICD-O
ICD-O
WHO:n alaluokitus ja vastaava ICD-O -koodi (SHR-muuttuja: icd-o-aml)
| AML, johon liittyy spesifinen toistuva geneettinen poikkeavuus | ICD-O | |
| AML ja t(8;21)(q22;q22); RUNX1-RUNX1T1 | 9896/3 | |
| AML ja inv(16)(p13.1q22) tai t(16;16)(p13.1;q22); CBFB-MYH11 | 9871/3 | |
| APL ja t(15;17)(q22;q12); PML-RARA* (FAB M3) | 9866/3 | |
| AML ja t(9;11)(p22;q23); MLLT3-MLL** | 9897/3 | |
| AML ja t(6;9)(p23;q34); DEK-NUP214 | 9865/3 | |
| AML ja inv(3)(q21q26.2) tai t(3;3)(q21;q26.2); RPN1-EVI1 | 9869/3 | |
| AML (megakaryoblastinen) ja t(1;22)(p13;q13); RBM15-MKL1 | 9911/3 | |
| AML ja mutatoitunut NPM1 (ehdollinen) | 9861/3 | |
| AML ja mutatoitunut CEBPA (ehdollinen) | 9861/3 | |
| AML, johon liittyy myelodysplastisia muutoksia*** | 9895/3 | |
| Aikaisempiin hoitoihin liittyvä AML # | 9920/3 | |
| Muutoin spesifioimaton AML | 9861/3 | |
| AML ja minimaalinen erilaistuminen (FAB M0) | 9872/3 | |
| AML ilman kypsymistä (FAB M1) | 9873/3 | |
| AML ja vähäinen kypsyminen (FAB M2) | 9874/3 | |
| AML, myelomonosyyttileukemia (FAB M4) | 9867/3 | |
| AML, monoblastinen/monosyyttinen leukemia (FAB M5a/M5b) | 9891/3 | |
| AML, akuutti erytroleukemia (FAB M6) | 9840/3 | |
| Puhdas erytroleukemia, Erytroleukemia (erytroinen/myelooinen) | ||
| AML, akuutti mekakaryoblastileukemia (FAB M7) | 9910/3 | |
| AML, akuutti basofiilinen leukemia | 9870/3 | |
| AML, panmyeloosi ja myelofibroosi (= akuutti myelofibroosi/myeloskleroosi) | 9931/3 | |
| Ekstramedullaarinen AML = myelooinen sarkooma, klorooma, | 9930/3 | |
| granulosyyttinen sarkooma) | ||
| Downin syndroomaan liittyvä AML | 9898/3 | |
| Blastinen plasmasytoidinen dendriittisoluleukemia | 9727/3 | |
| Akuutti leukemia, erilaistumislinja kaksisuuntainen/epäselvä | ||
| Akuutti erilaistumaton leukemia | 9801/3 | |
| Akuutti leukemia, sekafenotyyppi ja t(9;22)(q34;q11.2); BCR-ABL1 ## | 9806/3 | |
| Akuutti leukemia, sekafenotyyppi ja t(v;11q23); MLL:n uudelleenjärjestymä | 9807/3 | |
| Akuutti leukemia, sekafenotyyppi, B/myelooinen, muutoin spesifioimaton | 9808/3 | |
| Akuutti leukemia, sekafenotyyppi, T/myelooinen, muutoin spesifioimaton | 9809/3 | |
| NK solu lymfoblastinen leukemia/lymfooma (ehdollinen) | ||
*Muut RARA:aan liittyvät translokaatiot ilmaistaan erikseen: t(11;17)(q23;q12)=ZBTB16-RARA,
t(11;17)(q13;q12)=NUMA1-RARA, t(5;17)(q35;q12)=NPM1-RARA, tai STAT5B-RARA
**Muut MLL:aan liittyvät translokaatiot ilmaistaan erikseen: t(6;11)(q27;q23)=MLLT4-MLL, t(11;19)(q23;p13.3)=MLL-MLLT1, t(11;19)(q23;p13.1) =MLL-ELL, t(10;11)(p12;q23) =MLLT10-MLL
***>20 % blasteja veressä tai luuytimessä ja mikä tahansa seuraavista: aikaisempi MDS tai MDS/MPD, yli 50 % soluista vähintään kahdessa solulinjassa on dysplastisia, tai tautiin liittyy myelodysplasialle ominainen sytogeneettinen poikkeavuus, joita ovat: kompleksinen karyotyyppi (kolme tai useampi kromosomaalinen poikkeavuus), balansoimattomat löydökset: -7, del(7q), -5, del(5q), i(17q), i(17p), -13, del(13q), del(12p), t(12p), del(9q), idic(X)(q13), balansoidut löydökset: t(11;16)(q23;p13.3), t(3;21)(q26.2;q22.1), t(1;3)(p36.3;q21.1), t(2;11)(p21;q23), t(5;12)(q33;p12), t(5;7)(q33;q11.2), t(5;17)(q33;p13), t(5;10)(q33;q21), t(3;5)(q25;q34).
# Altistuminen sytotoksisille aineille: alkyloivat aineet, ionisoiva sädehoito, topoisomeraasi II:n inhibiittorit, muut.
## BCR-ABL1 positiivinen leukemia voi olla sekasolulinjainen akuutti leukemia, mutta se tulisi hoitaa kuten BCR-ABL1 positiivinen ALL.
ELN 2010 riskiluokitus
ELN 2010 riskiluokitus
AML-2012-tutkimuksen geneettinen riskiluokitus on seuraavanlainen (perustuu European LeukemiaNet:in suositukseen v. 2010):
Pieni riski (ryhmä I)
Seuraavat karyotyyppipoikkeavuudet (yksin tai muiden poikkeavuuksien yhteydessä)
- t(8;21) (q22;q22) [ RUNX1-RUNX1T1]
- inv16 (p13.1;q22)/t(16;16) (p13.1;q22) [CBFB-MYH11]
Normaali karyotyyppi seuraavien mutaatioiden yhteydessä
- NPM1-mutaatio ilman Flt3-ITD-mutaatiota
- kaksoismutatoitunut CEBPA ilman Flt3-mutaatiota
Keskiriski (Ryhmä II)
Normaali karyotyyppi seuraavien mutaatioiden yhteydessä:
- FLT3-ITD-mutaatio ja NPM1-mutaatio
- FLT3-ITD-mutaatio ilman NPM1-mutaatiota
Normaali karyotyyppi ilman FLT3-ITD- ja NPM1-mutaatioita
Seuraavat ryhmään I ja III kuulumattomat karyotyyppipoikkeavuudet
- t(9;11)(p22;q23); MLLT3-MLL
- muut ryhmään I ja III kuulumattomat karyotyyppipoikkeavuudet
Suuri riski (Ryhmä III)
Seuraavat karyotyyppipoikkeavuudet
- inv(3)(q21q26.2) / t(3;3)(q21;q26.2) [RPN1-EVI1]
- t(6;9)(p23;q34) [DEK-NUP214]
- t(v;11(v;q23) [uudelleenjärjestäytynyt MLL luk.ottamatta muutosta t(9;11)]
- -5, 5q-, -7, poikkeava 17p
- kompleksinen karyotyyppi (kolme tai useampi karyotyyppipoikkeavuus. Lukuun ei lasketa seuraavia: t(15;17), t(8;21), inv(16), t(16;16), t(9;11), t(v;11)(v;g23), t(6;9), inv(3), t(3;3))
- monosomaalinen karyotyyppi (yksi autosomin monosomia + yksi tai useampi rakenteellinen karyotyyppipoikkeavuus; kaksi tai useampi autosomin monosomiapoikkeavuutta)
Huom! Pienen riskin karyotyyppipoikkeavuuksia ja XY monosomioita ei lasketa mukaan
Seuranta ja vastearvio
Seuranta ja vastearvio
Sivusto siirtymässä toiseen osoitoitteseen. Ajankohtaiset ohjeet löytyvät toistaiseksi linkistä: https://www.hematology.fi/fi/hoito-ohjeet/veritaudit/akuutit-leukemiat/a...
Avainmuuttujat
Hoitotulosten arviointia varten potilaiden diagnoosivaiheen tietoja, annetut hoidot ja niiden vasteet kerätään Suomen hematologiseen rekisteriin (SHR) potilaan suostumuksella. AML-2012 ohjelmaan (vähimmäisvaatimuksena) kirjattavat tiedot on merkitty peukalomerkillä ( ).
Induktio‑ ja konsolidaatiovaiheen tutkimukset
Veritutkimukset hypoplasiavaiheessa
- Vähintään kolmesti viikossa: B-PVK+Ne ja P-CRP.
- Vähintään kahdesti viikossa: B-XKoe, P-Krea, P-K, P-Na, P-Bilir, P-ALAT, P-AFOS.
- Vähintään kerran viikossa: P-TT/INR, P‑Gluk, P-Alb, P-LD, P-Ca-ion, P-Pi, P-Mg, P-Uraat (vain ensimmäisen hoidon 2 ensimmäisen viikon aikana)
- Solujen toipumisvaiheessa on tärkeää tutkia blastien esiintymistä veressä: B-PVK+TKD
- Kuumeisten, pahoinvoivien ja ripuloivien potilaiden veren soluarvoja, CRP:tä, elektrolyyttejä, happo-emästasetta ja kreatiniinia seurataan päivittäin
- Infektionäytteiden aktiiviseen ottamiseen ja oikea‑aikaiseen lähettämiseen on kiinnitettävä erityistä huomiota (neutropeenisen potilaan infektiot)
Luuydinnäytteet induktiohoidon jälkeen
Hypoplasiavaihe induktiohoidon jälkeen, päivä 14 (suositus, ei kuulu AML2012-ohjelmaan)
- Aspiraationäytteen morfologinen näyte tutkitaan hypoplasian asteen ja leukemian refraktorisuuden arvioimiseksi. Toisinaan remissio tulee kuitenkin hitaasti eikä päivän 14 näytteen perusteella voida päätellä lopullista refraktorisuutta. Jos blasteja on ylimäärä, tutkitaan luuydin myös päivinä 21 ja 28, jotta mahdollinen reinduktio ei turhaan viivästyisi.
- Jos ensimmäisellä induktiohoidolla ei päästä remissioon, hypoplasiavaiheen näyte tutkitaan myös toisen induktiohoidon jälkeen.
Remission arviointi solujen toipuessa induktiohoidon jälkeen, päivä 28
Luuydinnäyte tutkitaan remission arvioimiseksi tutkitaan verisolujen noustessa hoidon jälkeen tai viimeistään päivänä 28. Tämän löydöksen sekä soluarvojen perusteella päätetään seuraavan hoidon aloittamisesta.
- Jos luuydin on vielä hypoplastinen ja veressä on merkittävä sytopenia, eikä seuraavaa solunsalpaajahoitoa voida aloittaa, luuytimen toipumista ja remission saavuttamista seurataan aspiraationäytteen morfologian avulla noin viikon välein.
- Tässä vaiheessa otetaan näyte (näytteet) myös jäännöstaudin arvioimiseksi, jos markkeri on.
Likvoritutkimus remission varmistamiseksi induktiohoidon jälkeen seuraavissa tilanteissa:
- DG-vaiheessa sytogeneettisenä muutoksena kromosomi 16:n inversio tai t(16;16)
- Dg-vaiheen B-leuk > 100 x 109/l
- Dg-vaiheessa ekstramedullaarinen tauti muualla kuin keskushermostossa
Luuydinnäytteet konsolidaatiohoidon jälkeen
Jokaisen konsolidaatiohoidon jälkeen otetaan luuydinnäytteet morfologisen remission ja jäännöstaudin arvioimiseksi.
Seurantavaiheen tutkimukset (AML-2012)
Luuydinnäytteestä tutkitaan allogeeniseen kantasolusiirtohoitoon soveltuvilta pienen riskin potilailta morfologian lisäksi jäännöstauti (RQ-PCR / FC-menetelmällä) 2 vuoteen saakka. Jos aiemmin jäännöstaudin suhteen negatiivisella potilaalla todetaan positiivinen tulos, ohjelmoidaan uusi näyte mahdollisimman pian.
- Merkittävän jäännöstaudin ilmaantuminen voi johtaa allogeeniseen kantasolusiirtoon tai siirron jo saaneilla aikaistettuun immunosuppression purkuun ja lyfosyyttisiirtoon kantasolujen luovuttajalta (DLI)
- Muissa riskiryhmissä jäännöstautiseuranta hoitavan yksikön harkinnan mukaisesti
- Uusi solunsalpaajahoito aloitetaan vasta kun todetaan morfologinen relapsi
Seurantaohjelma
1. vuosi konsolidaatiohoidon päättymisestä
- 1 kk välein B-PVK+TKD
- 3 kk välein luuytimen aspiraationäyte
- morfologia
- jäännöstauti (RQ-PCR ja tai FC-menetelmällä): allogeenisen kantasolusiirron piirissä olevilta pienen riskin potilailta, myös muissa riskiryhmissä suositeltava
2. vuosi konsolidaatiohoidon päättymisestä
- 3 kk välein B-PVK+TKD
- 3 kk välein luuytimen aspiraationäyte
-
- morfologia
- jäännöstauti (RQ-PCR ja tai FC-menetelmällä): allogeenisen kantasolusiirron piirissä olevilta pienen riskin potilailta, myös muissa riskiryhmissä suositeltava
-
3.-4. vuosi (5 vuoteen saakka) konsolidaatiohoidon päättymisestä
- 4 - 6 kk välein B-PVK+TKD
- Luuytimen aspiraatiotutkimus tehdään, jos soluarvot tai oireet antavat siihen aihetta
Seurantapaikka
- HUS: Remissiossa olevat HUS:n piirin potilaat seurataan 5 v ajan hoitojen päättymisestä HUS:n sairaaloissa ja sen jälkeen, jos erityisiä ongelmia ei ole, TK:ssa tai muun oman lääkärin toimesta. Muiden keskusairaaloiden alueiden potilaat seurataan ao. keskussairaalan toimesta, kun konsolidaatiohoidot on annettu.
Tutkimukset epäiltäessä relapsia
Granulosytopenian, trombosytopenian tai anemian kehittyminen tai paheneminen voivat viitata relapsiin ja ne samoin kuin blastien ilmaantuminen vereen, indisoivat luuytimen aspiraationäytteen tutkimisen. Erityisen tiiviisti on syytä seurata niitä potilaita, joiden relapsivaiheen hoidossa kantasolujensiirto voi tulla kyseeseen.
Anamneesi: vuototaipumus, infektio, yleisoireet, kivut, päänsärky, pahoinvointi
Status: petekiat, mustelmat, infektiofokukset, hepatosplenomegalia, lymfadenopatia, tuumorit, ihoinfiltraatio, ienhyperplasia, aivohermojen löydökset
Veri- ja virtsakokeet: B-PVK+TDK, CRP,P-Krea, P-K, P-Na, P-Bilir, P-ALAT, P-AFOS, P-TT, P‑Gluk, P-Alb, P-LD, P-Ca-ion, P-Pi, P-Mg, P-Uraat, B-Xkoe
Luuytimen aspiraationäyte:
- MGG‑värjäys, muut värjäykset harkinnan mukaan
- Kromosomitutkimus harkinnan mukaan
- Pintamerkkitutkimus harkinnan mukaan
- Jäännöstaudin seurantamarkkeri harkinnan mukaan
Taudin status
- Kirjaudu tai rekisteröidy kommentoidaksesi
Taudin status
Vastearvion yhteydessä pyritään tautitaakan arvio ja taudin tilanne luokittelemaan oheisen taulukon mukaisesti (SHR-muuttuja: disease_status). Taulukosta valitaan arviointihetkellä oleva paras vaste.
|
Lyhenne |
Nimike |
Määritelmä |
|
CR-MRDneg |
Remissio, jäännostauti negatiivinen |
|
|
CR-MRDpos |
Remissio, jäännostauti positiivinen |
|
|
CCR |
Sytogeneettinen remissio |
|
|
CR |
Morfologinen remissio |
|
|
CRi |
Remissio, puutteellinen luuytimen toipuminen |
|
|
PR |
Osittainen remissio |
|
|
Hypoplasia |
Dysplasia/hypoplasia |
|
|
RD |
Refraktaari tauti (RD) |
|
|
Relapsi (MRD) |
Molekyyligenettinen relapsi |
|
|
Relapsi (bm) |
Relapsi |
|
|
Relapsi (neuro) |
Isololoitu neurorelapsi |
|
|
Relapsi (ekstram) |
Isololoitu ekstramedullaarinen relapsi |
|
| Exitus- refraktaari | Exitus, refraktaari tauti |
|
|
Exitus-relapsi |
Exitus, relapsi |
|
|
Exitus-infektio |
Exitus, infektio |
|
|
Exitus-aplasia |
Exitus, aplasia |
|
|
Exitus-hoitoon liittyvä (TRM) |
Exitus, hoitoon liittyvä |
|
|
Exitus-muu tauti |
Exitus toisesta taudista johtuen |
|
| Exitus - ei hoitoa | Exitus, hoito keskeytetty |
|
| Exitus - ei edeltävää hoitoa |
Exitus, palliatiivinen hoito |
|
|
Exitus-tuntematon |
Exitus, syy tuntematon |
|
|
Poistunut seurannasta |
Seuranta loppunut (lost-to-follow-up) |
|
Hoito
Hoito
Sivusto siirtymässä toiseen osoitteseen. Ajankohtaiset ohjeet löytyvät toistaiseksi linkistä: https://www.hematology.fi/fi/hoito-ohjeet/veritaudit/akuutit-leukemiat/a...
AML-potilaat hoidetaan ensisijaisesti SLR:n AML-2018-hoito-ohjelman mukaisesti. Akuutti promyelosyyttileukemia (APL) hoidetaan erillisen ohjeen mukaisesti.
AML-2012 (vanha protokolla)
- Kirjaudu tai rekisteröidy kommentoidaksesi
AML-2012 (vanha protokolla)
Täältä löydät tietoa Suomen leukemiaryhmän AML-2012-hoito-ohjelmasta (lopullisen version päiväys 11.01.2012). Se on kokonaisuudessaan ladattavissa alla olevasta liitetiedostosta (attachment). Alla otsikoittain jaoteltuna on esitetty keskeiset osiot hoito-ohjelmasta.
Tiivistelmä AML-2012
- Kirjaudu tai rekisteröidy kommentoidaksesi
Tiivistelmä AML-2012
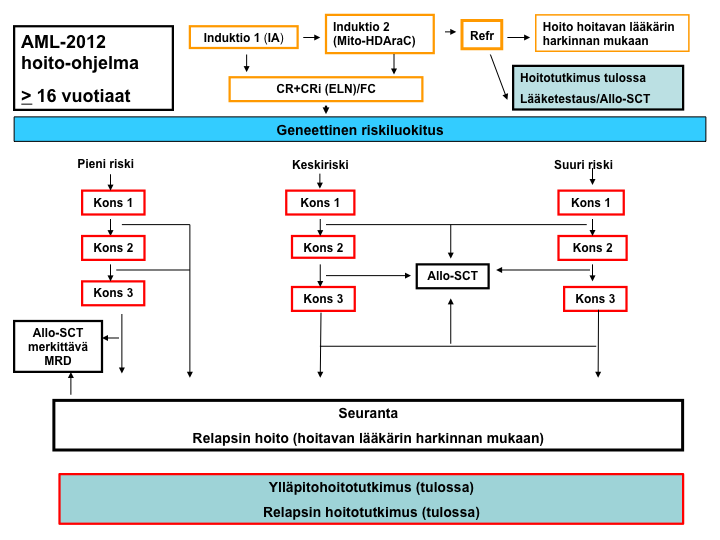
Kyseessä on 16-vuotiaille ja sitä vanhemmille akuuttia myelooista leukemiaa (AML) sairastaville potilaille tarkoitettu valtakunnallinen Suomen leukemiaryhmän (SLR) laatima hoito-ohjelma, jonka tarkoitus on saada kaikki yli 65-vuotiaat potilaat yhtenäisen hoidon piiriin.
Hoito-ohjelmaan soveltuva potilas saa aluksi induktiohoidon (enimmillään kaksi sykliä), jolla tähdätään morfologiseen remissioon. Remissio pyritään mahdollisuuksien mukaan arvioimaan luuydinnäytteestä myös virtaussytometrisellä menetelmällä. Morfologisen remission saavuttaneet potilaat jaetaan kolmeen eri riskiluokkaan (pieni riski, keskiriski ja suuri riski) dg-vaiheessa otettujen geneettisten tutkimustulosten mukaisesti. Jokaisessa riskiluokassa toteutetaan remission jälkeen konsolidaationa enimmillään kolme solunsalpaajahoitoa, jonka jälkeen siirrytään seurantaan. Kuitenkin kaikille niille remission saavuttaneille allogeeniseen siirtoon soveltuville keskiriskin ja suuren riskin potilaille, joille sopiva luovuttaja löytyy, suositellaan ensimmäisessä remissiossa konsolidaationa allogeenista kantasolusiirtohoitoa heti kun se on mahdollista toteuttaa. Pienen riskin potilaille suositellaan allogeenista kantasolusiirtohoitoa ensimmäisessä remissiossa vain, jos kolmen konsolidaatiohoidon jälkeen heillä on molekulaarisesti mitattava merkittävä jäännöstauti.
Jäännöstautia seurataan allogeeniseen kantasolusiirtohoitoon soveltuvilla geneettisesti pienen riskin potilailla jokaisen hoidon jälkeen ja seurantavaiheessa kolmen kuukauden välein kahteen vuoteen saakka remission toteamisesta. Jos tällaiselle potilaalle ilmaantuu seurannan aikana merkittävä jäännöstauti, hänelle suositellaan allogeenista kantasolusiirtohoitoa, jos se on mahdollista toteuttaa. Muissa riskiryhmissä jäännöstaudin seuranta ei ole välttämätön, mutta sitä suositellaan tehtäväksi kuten pienen riskin ryhmässä, tutkimustiedon kartuttamiseksi tulevia hoitotutkimuksia ajatellen. Pienen riskin potilaille jäännöstaudin seurantaan soveltuvin menetelmä on RQ-PCR. Muissa riskiryhmissä jäännöstaudin seurantaan käytetään soveltuvinta herkintä menetelmää. Jäännöstaudin seurantaa suositellaan tehtäväksi myös virtaussytometrialla.
Induktiohoidolle refraktaaristen ja hoidon tai seurannan aikana relaboituvien potilaiden jatkohoidosta päättää hoitava lääkäri.
Potilaat ja hoitotulosten arvioimisessa tarvittavat seurantatiedot (erillinen raportointiliite) ilmoitetaan potilaan antamalla kirjallisella suostumuksella Suomen Hematologiseen Rekisteriin (SHR). Jokainen vastuulääkäri ohjeistaa ERVA-alueensa keskussairaalat hoito-ohjelman ja sen raportoinnin suhteen.
Hoito-ohjelmassa mukana oleville potilaille suositellaan osallistumista mahdollisesti myöhemmin käynnistyviin erillisiin SLR:n suunnittelemiin AML:n tutkimuksiin.
Hoito-ohjelmaan pyritään saamaan 400 potilasta vuosien 2012 - 2015 aikana.
Vuokaaviot (AML-2012)
- Kirjaudu tai rekisteröidy kommentoidaksesi
Vuokaaviot (AML-2012)
AML-2012-hoito-ohjelma: yleiskaavio
Pienen relapsiriskin hoitokaavio
Keskisuuren relapsiriskin hoitokaavio
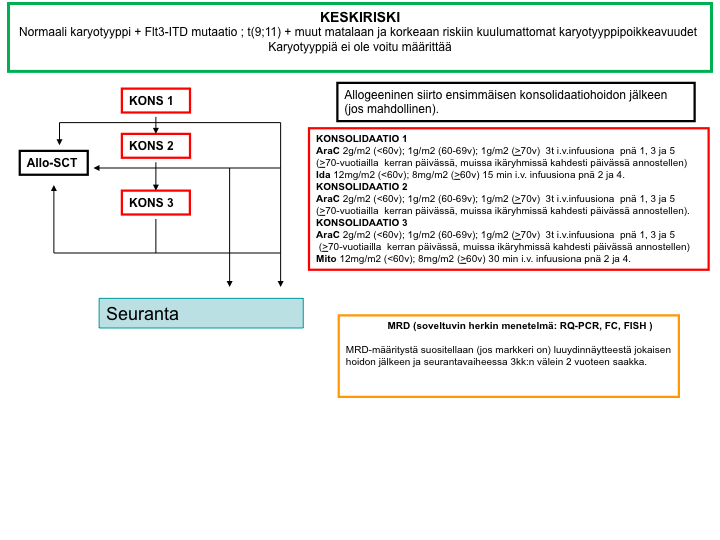
Suuren relapsiriskin hoitokaavio
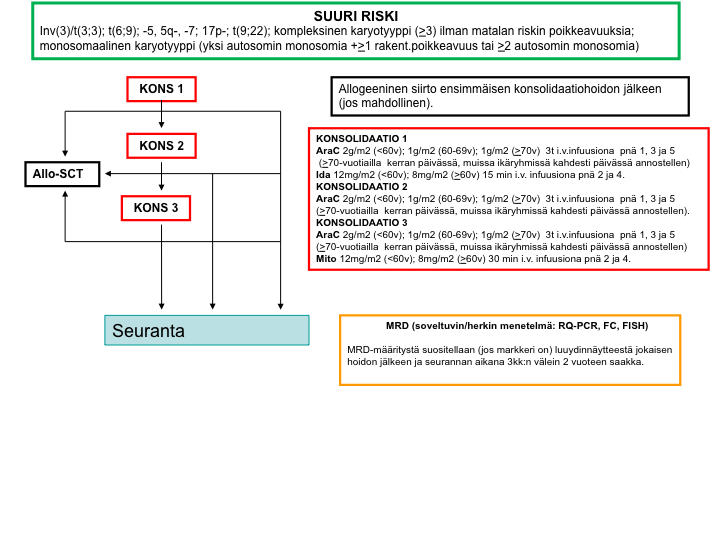
Valintakriteerit
- Kirjaudu tai rekisteröidy kommentoidaksesi
Valintakriteerit
- Potilaan ikä on dg-hetkellä >16 vuotta
- Potilaalla on AML WHO-kriteerien mukaisesti
- Allekirjoitettu kirjallinen suostumus tietojen tallentamisesta Suomen Hematologiseen Rekisteriin (FHRB)
Poissulkukriteerit
- Akuutti promyelosyyttileukemia
- Soveltumattomuus hoito-ohjelmaan: vaikea sydän-, keuhko-, maksa- tai munuaissairaus, vaikea psykiatrinen sairaus/tila, vaikea dementia, huono hoitomyöntyvyys
- Arvioitu elinaika leukemiasta riippumattomasta syystä on alle 6 kk.
Hoito-ohjelman ensisijaiset päätetapahtumat
- Remissio (CR)
- Relapsivapaa elinaika (RFS)
- Kumulatiivinen relapsin insidenssi (CIR)
- Kokonaiselinaika
Hoito-ohjelman toissijaiset päätetapahtumat
- Induktio- ja konsolidaatiohoidon kuolleisuus
- Hoitosyklin viivästymisen syyt
- Hoito-ohjelman keskeyttämisen syyt
Muita raportoitavia parametreja
Jokaisesta hoitosyklistä:
- Neutropenian kesto (<0.5)
- Trombosytopenian kesto (<50)
- Infektioiden vaikeusaste (WHO-luokitus)
- Veriviljelypositiiviset infektiot
- Sairaalapäivät
- Jäännöstaudin määrä
Seurantavaihe:
- Jäännöstaudin määrä 3 kk välein 2 vuoteen saakka
Induktiohoidot (AML-2012)
- Kirjaudu tai rekisteröidy kommentoidaksesi
Induktiohoidot (AML-2012)
Ensimmäinen induktio (IA)
Idarubisiini (Ida): 12 mg/m2 päivinä 1, 3 ja 5 15 min iv infuusiona (sama annos kaikissa ikäryhmissä)
Sytarabiini (AraC):
• <60-vuotiaat: bolus 100 mg päivänä 1 ja 100 mg/m2 jatkuvana iv infuusiona pnä 1-9
• ≥60-vuotiaat: bolus 100 mg päivänä 1 ja 100 mg/m2 jatkuvana iv infuusiona pnä 1-7
Toinen induktio (Mito-HDAraC)
Se annetaan vain, jos potilas ei mene morfologiseen remissioon ensimmäisellä induktiolla.
Mitoksantroni (Mito):
• <60-vuotiaat: 12 mg/m2 30 min iv. infuusiona pnä 2-5
• ≥60-vuotiaat: 8 mg/m2 30 min iv. infuusiona pnä 2-5
Suuriannos-sytarabiini (HDAraC):
• <60-vuotiaat: 2 g/m2 3 tunnin iv. infuusiona 12 tunnin välein päivinä 1, 3, 5 ja 7
• 60-69-vuotiaat: 1 g/m2 3 tunnin iv. infuusiona 12 tunnin välein päivinä 1,3, 5 ja 7
• ≥70-vuotiaat: 1 g/m2 3 tunnin iv. infuusiona kerran päivässä päivinä 1, 3, 5 ja 7
• Oftan Dexa silmätipat 1gttx4-6 molempiin silmiin pnä 1-8
Konsolidaatiohoidot (AML-2012)
- Kirjaudu tai rekisteröidy kommentoidaksesi
Konsolidaatiohoidot (AML-2012)
Ensimmäinen konsolidaatiohoito (HDAraC-Ida)
Annetaan vain, jos potilas saavuttaa morfologisen remission joko ensimmäisellä tai toisella induktiohoidolla.
Suuriannos-sytarabiini (HDAraC):
• <60-vuotiaat: 2 g/m2 3 tunnin iv. infuusiona 12 tunnin välein pnä 1, 3 ja 5
• 60-69-vuotiaat: 1 g/m2 3 tunnin iv infuusiona 12 tunnin välein pnä 1, 3 ja 5
• ≥70-vuotiaat: 1 g/m2 3 tunnin iv. infuusiona kerran päivässä pnä 1, 3 ja 5
• deksametasoni-silmätipat 1 gtt x4-6 molempiin silmiin pnä 1-6
Idarubisiini:
• <60-vuotiaat: 12 mg/m2 15 min iv. infuusiona pnä 2 ja 4
• ≥60-vuotiaat: 8 mg/m2 15 min iv. infuusiona pnä 2 ja 4
Toinen konsolidaatiohoito (HDAraC)
Se annetaan vain, jos potilas on morfologisessa remissiossa.
Suuriannos-sytarabiini (HDAraC):
• <60-vuotiaat: 2 g/m2 3 tunnin iv. infuusiona 12 tunnin välein pnä 1, 3 ja 5
• 60-69-vuotiaat: 1 g/m2 3 tunnin iv infuusiona 12 tunnin välein pnä 1, 3 ja 5
• ≥70-vuotiaat: 1 g/m2 3 tunnin iv. infuusiona kerran päivässä pnä 1, 3 ja 5
• deksametasoni-silmätipat 1 gtt x4-6 molempiin silmiin pnä 1-6
Kolmas konsolidaatiohoito (HDAraC-Mito)
Se annetaan vain, jos potilas on morfologisessa remissiossa.
Suuriannos-sytarabiini (HDAraC):
• <60-vuotiaat: 2 g/m2 3 tunnin iv. infuusiona 12 tunnin välein pnä 1, 3 ja 5
• 60-69-vuotiaat: 1 g/m2 3 tunnin iv infuusiona 12 tunnin välein pnä 1, 3 ja 5
• ≥70-vuotiaat: 1 g/m2 3 tunnin iv. infuusiona kerran päivässä pnä 1, 3 ja 5
• deksametasoni-silmätipat 1 gtt x4-6 molempiin silmiin pnä 1-6
Mitoksantroni (Mito):
• <60-vuotiaat: 12 mg/m2 30 min iv. infuusiona pnä 2 ja 4
• ≥60-vuotiaat: 8 mg/m2 30 min iv. infuusiona pnä 2 ja 4
Kantasolujensiirto (kriteerit AML-2012)
- Kirjaudu tai rekisteröidy kommentoidaksesi
Kantasolujensiirto (kriteerit AML-2012)
Pienen riskin AML-potilailla valmistaudutaan kolmannen hoidon jälkeen tehtävään allogeeniseen kantasolusiirtohoitoon, jos aikaisempien hoitojen jäännöstaudin perusteella se näyttää todennäköiseltä. Jos siirto ei ole mahdollinen, siirrytään seurantavaiheeseen.
Keskisuuren ja suuren riskin ryhmässä tehdään allogeeninen kantasolujensiirto kahden hoidon jälkeen tai sen jälkeen heti kun se on mahdollista, jos sopiva luovuttaja (sisarus tai rekisteristä peräisin oleva) on olemassa ja siirto muutoin on mahdollista toteuttaa. Jos luovuttajaa ei ole, annetaan potilaille yhteensä kolme konsolidaatiota. Kolmen konsolidaatiohoidon jälkeen tai konsolidaatiohoitojen keskeytyessä siirrytään seurantavaiheeseen.
Allogeenista kantasolujensiirtohoitoa tarjotaan edellä esitetyin perustein siirtoon soveltuvalle potilaalle 65 ikävuoteen saakka ja yksilöllistä harkintaa käyttäen aina 70 ikävuoteen saakka, jos hänelle löytyy sopiva luovuttaja. Siirtoon soveltuvista keskiriskin ja suuren riskin potilaista laaditaan lähete allogeeniseen siirtoyksikköön (HYKS tai TYKS) mahdollisimman varhaisessa vaiheessa. Myös pienen riskin potilaiden siirtoon varaudutaan mahdollisimman varhain jäännöstaudin tulos huomioiden. Lähetteeseen liitetään liitteen 7 mukaiset tiedot (ks. erillinen linkki ja protokolla). Jos sisarusluovuttajaa ei löydy, siirtokeskus ryhtyy etsimään rekisteriluovuttajaa. Samanaikaisesti tiiviisti seurataan potilaan hoidon etenemistä ja mahdollisten komplikaatioiden syntymistä. Jos potilaalle löytyy sisarusluovuttaja tai rekisteristä löytyy kudostyypiltään sopiva luovuttaja (siirtokeskuksen tekemä valinta), käydään siirtokeskuksessa keskustelu allogeeniseen siirtoon liittyvistä asioista potilaan, lähiomaisen ja mahdollisen sisarusluovuttajan kesken. Kun potilas on ilmoittanut keskustelun jälkeen haluavansa edetä siirtoon (ja sisarusluovuttaja samoin), voidaan tautitilanteen salliessa ryhtyä aktivoimaan siirtoaikataulua. Noin kolme viikkoa ennen kantasolujen siirtopäivää potilas ja sisarusluovuttaja tutkitaan polikliinisesti siirtoyksikössä. Mikäli tutkimuksissa ei ilmene estettä, edetään suunniteltuun intensiivihoitoon. Rekisterin luovuttaja tutkitaan rekisterin toimesta. Lopullisen arvion potilaan sopivuudesta siirtoon, luovuttajan valinnan ja potilaalle annettavan esihoidon tekee siirtoyksikkö.
Keskiriskin ja suuren riskin potilailla siirtoon pääsyn optimaalisin ajankohta on induktion tai yhden konsolidaation jälkeen.
Tietojen rekisteröinti
- Kirjaudu tai rekisteröidy kommentoidaksesi
Tietojen rekisteröinti
Hoito-ohjelman tiedot ovat SLR:n omaisuutta. Raportoitavat tiedot siirretään potilaan kirjallisella suostumuksella Suomen Hematologiseen Rekisteriin (SHR/FHRB). Raportoitavat tiedot voidaan siirtää joko suoraan rekisteriin tai ne voidaan ensin kerätä erillisille kaavakkeille ja niistä myöhemmin siirtää rekisteriin. Tietojen siirtäminen rekisteriin edellyttää sitä, että SHR on hyväksytty sairaanhoitopiireissä käyttöön (eettisen toimikunnan kannanotto ja shp:n johtajaylilääkärin hyväksyntä). Jokaisen ERVA-alueen vastuulääkäri huolehtii siitä, että SHR on saanut hyväksynnän alueellaan. Hän myös ohjeistaa tietojen keräämisen vastuualueellaan. Kerättyjä tietoja käsitellään salassa pidettävien tietojen vaatimusten mukaisesti. Vain nimettyjen henkilöiden on mahdollista tarkastella hoitotuloksia. SHR:n tiedoista tehdyistä yhteenvedoissa ja raporteissa yksittäisten potilaiden tietoja ei voida tunnistaa.
Allogeenisen kantasolusiirtohoidon saaneet potilaat raportoidaan tästä riippumatta transplantaatiorekistereihin normaalin käytännön mukaisesti ja tuloksia voidaan käyttää rekisterien tekemissä analyyseissä. Hoito-ohjelman tuloksista raportoidaan leukemiaryhmälle ja ne hyödynnetään niissä erillisissä hoitotutkimuksissa, joihin potilaita tästä hoito-ohjelmasta mahdollisesti suositellaan. Hoitotulokset pyritään myös raportoimaan alan kansainvälisissä lehdissä SLR:n toimesta. SLR päättää julkaisujen kirjoittajista erikseen.
Vastuulääkärit
- Kirjaudu tai rekisteröidy kommentoidaksesi
Vastuulääkärit
Pirjo Koistinen
AML-2012-hoito-ohjelman vastuuhenkilö
Syöpätaudit ja hematologia, Medisiininen tulosalue, OYS
PL 20, 90029 OYS
pirjo.koistinen@ppshp.fi, puh (08) 315 4617
Kimmo Porkka
Hematologian klinikka, Medisiininen tulosyksikkö, HYKS
PL 372, Haartmaninkatu 4, 00029 HUS
kimmo.porkka@helsinki.fi, puh. 09 471 72338
Tapio Nousiainen
Sisätautien klinikka, KYS
PL 1777, 70211 Kuopio
tapio.nousiainen@kuh.fi, puh. (017) 173 311
Maija Itälä-Remes
osasto 015, TYKS
PL52, 20521 Turku
maija.itala-remes@tyks.fi, puh (02) 313 0000
Hannele Rintala
Sisätautien klinikka, TAYS
PL 2000, 33521 Tampere
hannele.rintala@pshp.fi, puh (03) 311 611
Potilaan tiedote
- Kirjaudu tai rekisteröidy kommentoidaksesi
Potilaan tiedote
Versio 17.04.2012
Tietoa akuutista myelooisesta leukemiasta ja sen uudesta suomalaisesta hoito-ohjelmasta
16-VUOTIAIDEN JA SITÄ VANHEMPIEN AKUUTTIA MYELOOISTA LEUKEMIAA SAIRASTAVIEN POTILAIDEN HOITO-OHJELMA
Lyhenne: AML-2012
Arvoisa potilas
Tässä tiedotteessa kerrotaan akuutin myelooisen leukemian uudesta hoito-ohjelmasta, jonka piiriin pyritään saamaan mahdollisimman moni kyseiseen leukemiaan sairastuva aikuispotilas Suomessa. Hoito-ohjelma on Suomen Leukemiaryhmän laatima ja siinä hyödynnetään viimeaikaisin tutkimustieto taudista ja sen hoidosta.
Akuutin myelooisen leukemian hoidon yleisiä periaatteita
Akuutti myelooinen leukemia on aikuisten yleisin akuutti leukemia, jossa luuydin tuottaa epäkypsiä blastisoluja (leukemiasoluja) verenkiertoon, josta ne voivat levitä muualle elimistöön. Samanaikaisesti luuytimen normaali verisolumuodostus estyy ja aiheuttaa anemian, terveiden valkosolujen vähyyden ja verihiutaleiden kadon. Terveiden valkosolujen vähyys johtaa toistuviin infektioihin ja verihiutaleiden eli trombosyyttien kato lisää verenvuotoja. Veren suuri blastimäärä voi johtaa verenkiertohäiriöihin ja eri elinten normaalin toiminnan häiriintymiseen. Hoitamattomana tauti johtaa nopeasti kuolemaan.
Akuutin myelooisen leukemian hoidon kulmakivi on suuriannoksinen solunsalpaajalääkitys, joita annetaan muutaman päivän kuureina 4 – 6 viikon välein. Yleensä hoitokuureja tarvitaan useita. Hoidon päämääränä on taudista paraneminen, johon päästään tuhoamalla kaikki elimistössä olevat leukemiasolut.
Leukemian hoidot aiheuttavat veren kaikkien soluarvojen voimakkaan mutta ohimenevän laskun, mikä selittää suuren osan hoitoon liittyvistä haittavaikutuksista. Haittavaikutuksina voi esiintyä väsymystä, tulehduksia ja verenvuotoja. Suun kipeytyminen, ruokahaluttomuus, pahoinvointi, ripuli ja hiusten lähtö ovat myös tavallisia. Mahdollisuus lasten saamiseen huononee hoitojen takia.
Suurin osa haittavaikutuksista on kuitenkin pääsääntöisesti hoidettavissa tukihoidoin. Tukihoitoina tarvitaan verituotteita ja antibiootteja, joita annetaan toistuvasti laskimonsisäisesti. Hoitojen aikana joudutaan turvautumaan usein myös suonensisäiseen ravitsemushoitoon. Hoitojen helpottamiseksi tarvitaan lähes poikkeuksetta keskuslaskimokatetria, jonka anestesialääkäri laittaa paikallispuudutuksen avulla suureen laskimoon. Katetri on tarkoitettu pitkäaikaiseen käyttöön, eikä se estä esimerkiksi kotona käymistä hoitojen välissä.
Ensimmäisellä hoitojaksolla pyritään saavuttamaan remissio, jolloin leukemiasoluja ei enää nähdä luuytimessä, veriarvot ovat normaalistuneet ja leukemian mahdollisesti aiheuttamat oireet ovat hävinneet. Myöhempien hoitojaksojen tarkoituksena on hävittää mahdollinen mikroskoopilla havaitsematon jäännöstauti ja estää taudin uusiutuminen eli relapsi.
Normaalin käytännön mukaisesti hoidon tuloksia seurataan veri- ja luuydinnäytteiden avulla. Verinäytteitä otetaan voimakkaiden hoitojen jälkeen lähes päivittäin. Luuydinnäytteitä tutkitaan noin kuukauden kuluttua ensimmäisen hoidon alusta ja myöhemmin hoitokuurien jälkeen veriarvojen toivuttua sekä seurantavaiheessa neljä kertaa vuodessa kahden vuoden ajan. Kantasolujensiirron hyödyistä ja riskeistä järjestetään erillinen keskustelu niille potilaille, jotka ovat siihen soveliaita ja joille tätä hoitomuotoa tarjotaan 1 – 3 solunsalpaajakuurin jälkeen.
Hoitokuurit annetaan yleensä sairaalassa. Infektioiden ja verenvuotojen vaaran takia joudutaan hoitokuurien jälkeen olemaan sairaalassa yleensä muutamia viikkoja. Sairaalahoitojaksojen välillä lyhyet kotilomat ovat usein mahdollisia.
Hoito-ohjelman suunnittelija – Suomen Leukemiaryhmä
Maassamme akuuttien leukemioiden hoito ohjelmat on suunniteltu yli 25 vuoden ajan Suomen Leukemiaryhmän toimesta. Ryhmään kuuluu lääkäreitä pahanlaatuisia veritauteja hoitavista sairaaloista. Yhteisen suunnittelun ja tulosten seuraamisen tarkoituksena on kehittää Suomen oloihin parhaiten soveltuvia ja tehokkaita hoito ohjelmia. Käsillä oleva hoito-ohjelma toteutetaan kaikissa Suomen yliopistollisissa sairaaloissa ja joissakin keskussairaaloissa. Tähän mennessä toteutetuilla hoito- ja tutkimusohjelmilla saavutetut hoitotulokset ovat parantuneet koko ajan ja ovat myös kansainvälisesti arvioituna korkeatasoisia.
Miksi tämä hoito-ohjelma on laadittu?
Leukemian hoidossa käytetään monenlaisia solunsalpaajahoitojen yhdistelmiä, joilla on saavutettu kohtalaisen hyviä hoitotuloksia. Tällä hetkellä ei voida sanoa mikä yhdistelmistä on kaikkein paras. Tämän takia yksityiskohdiltaan toisistaan eroavia hoito-ohjelmia on syytä edelleen arvioida niin tehon kuin haittavaikutustenkin suhteen.
Tässä hoito-ohjelmassa kaikki potilaat saavat saman remissioon tähtäävän induktiohoidon sekä remission saavuttamisen jälkeen kolme konsolidaatiohoitoa taudin uusiutumisen estämiseksi. Potilaat jaetaan tiettyjen diagnoosivaiheessa todettujen riskitekijöiden perusteella kolmeen eri riskiluokkaan, mikä vaikuttaa siihen, suositellaanko etenemistä allogeeniseen kantasolusiirtoon, jos sopiva kantasolujen luovuttaja löytyy.
Akuutin myelooisen leukemian ennuste vaihtelee potilaittain huomattavasti. Diagnoosivaiheen löydösten perusteella hoitovasteen saannin mahdollisuutta ja leukemian uusiutumisen riskiä voidaan arvioida monin tavoin. Viime vuosina sairaalakäyttöön on kehitetty aiempaa herkempiä menetelmiä elimistöön hoidon jälkeen mahdollisesti jäävien leukemiasolujen eli jäännöstaudin toteamiseksi. Herkät tutkimusmenetelmät ovat tuoneet runsaasti uutta tietoa leukemian hoitoon, mutta niihin liittyy myös runsaasti selvitettäviä kysymyksiä sekä laboratoriotekniikan että tulosten arvioinnin kannalta. Tässä hoito-ohjelmassa nämä riskitekijät kartoitetaan uusien kansainvälisten ohjeiden mukaisesti ja mahdollista jäännöstautilöydöstä pyritään seuraamaan luuydinnäytteestä säännöllisin väliajoin aina 2 vuoteen saakka sairastumisesta.
Hoito-ohjelman tavoite
Hoitojen jatkuvan kehittämisen takia on tärkeää kerätä tiedot paitsi hoitotuloksista myös leukemian luonteesta ja potilaskohtaisista hoidon tuloksiin vaikuttavista tekijöistä. Ohjelmaan pyritään saamaan kaikki Suomessa hoidettavat 16-vuotiaat ja sitä iäkkäämmät voimakkaaseen solunsalpaaja-hoitoon soveltuvat akuuttia myelooista leukemiaa sairastavat potilaat. Hoitoon soveltuvuuttaa arvioidaan aikaisempaa paremmin hyödyntäen WHO:n toimintakykymittaristoa sekä muun sairastavuuden pisteytystä siihen kehitetyillä ohjeistuksilla.
Hoito-ohjelman tärkeä tavoite on saada myös iäkkäät potilaat parantavan hoidon piiriin ja samalla arvioida, parantaako voimakas hoito iäkkäiden potilaiden ennustetta, ja onko hoidon toksisuus hyväksyttävissä. Alle 65-vuotiaiden kohdalla hoitotuloksia voidaan verrata historiallisiin kontrolleihin eli AML-92 ja AML-03-hoitotutkimuksiin osallistuneiden potilaiden hoitotuloksiin.
Tässä hoito-ohjelmassa potilaiden ohjaaminen allogeeniseen kantasolusiirtohoitoon nopeutuu ja tehostuu. Samalla kaikki (myös iäkkäät) yleisten suositusten mukaan allogeenisen kantasolusiirtohoidon piiriin kuuluvat potilaat saadaan systemaattisesti poimittua siirto-ohjelmaan.
Hoito-ohjelman yksi tavoite on arvioida jäännöstaudin merkitys kaikissa riskiryhmissä potilaan ennusteeseen. Tässä hoito-ohjelmassa tätä tietoa kerätään entistä systemaattisemmin ja useammalla eri menetelmällä. Tieto voidaan hyödyntää tulevaisuudessa arvioitaessa sitä, missä vaiheessa ja minkä suuruinen jäännöstauti tulisi hoitoa tehostamalla pyrkiä eliminoimaan.
Diagnoosi-, remissio- ja mahdollisessa relapsivaiheessa kerättävät veri- ja luuydinnäytteet, sekä kliinisen tiedon keräys Suomen hematologiseen rekisteriin ja biopankkiin (FHRB) mahdollistavat akuutin leukemian hoidon jatkuvan kehitystyön. Rekisteriin kerätty data helpottaa ja nopeuttaa hoito-ohjelman tulosten tilastollista analysointia ja väliraporttien tekemistä. Tästä tutkimuksesta saatte erillisen tiedotteen ja suostumuskaavakkeen.
Teiltä pyydetään kirjallinen suostumus biopankkinäytteiden ottamiseen sekä hoitotietojen siirtämiseen ja raportointiin Suomen Hematologiseen Rekisteriin. Mahdollinen kieltäytymisenne tietojenne rekisteröinnistä tai tutkimusnäytteiden otosta ei vaaranna tautinne hoitoa tämän hoito-ohjelman tai muun tunnetun hoito-ohjeistuksen mukaisesti. Kaikki hoito-ohjelman aikana kerätty tieto käsitellään luottamuksellisena eikä hoito-ohjelmaan osallistuvan henkilöllisyys käy ilmi tehtävissä yhteenvedoissa eikä raporteissa. Suomen Hematologista Rekisteriä, johon tiedot kootaan, säilytetään tietosuojalainsäädännön edellyttämällä tavalla ja sen käyttö on hyväksytty Teitä hoitavassa sairaalassa.
APL
- Kirjaudu tai rekisteröidy kommentoidaksesi
APL
Sivusto on siirtymässä toiseen osoitteseen. Akuutin promyelosyyttileukemian (APL) hoito-ohje (Suomen AML-ryhmä) alla, muut ohjeet ks https://www.hematology.fi/fi/hoito-ohjeet/veritaudit/akuutit-leukemiat/a...
Hoito-ohjelmia
- Kirjaudu tai rekisteröidy kommentoidaksesi
Hoito-ohjelmia
AI-ETI
- Kirjaudu tai rekisteröidy kommentoidaksesi
AI-ETI
Suomen leukemiaryhmän AML96 ohjelman hoito. Hoito on verraten hyvin siedetty, mutta relapseja tulee runsaasti. Induktiohoitona on 6 päivän AI-hoito, minkä jälkeen annetaan kaksi ETI-hoitoa. Näiden jälkeen annetaan oraalista merkaptopuriini- metotreksaatti -ylläpitohoitoa kunnes kolme vuotta on kulunut diagnoosihetkestä tai kunnes ilmaantuu relapsi.
Käyttöaiheet
- Iäkkäiden AML-taudin hoito
AI-hoito 6 päivää
- Sytarabiini 100 mg/m2 x 2 15 minuutin infuusiona 12 tunnin välein päivinä 1-6
- Idarubisiini 12 mg/m2 10 minuutin infuusiona päivinä 4 ja 6 (2 annosta)
ETI‑hoito
- Etoposidi 80 mg/m2 x 2 po. päivinä 1‑5
- Tioguaniini 100 mg/m2 x 2 po. päivinä 1‑5
- Idarubisiini 15 mg/m2 x 1 po. päivinä 1‑3
Merkaptopuriini ‑ metotreksaatti ‑ ylläpitohoito
- Merkaptopuriini 70 mg/m2 kerran päivässä po.
- Metotreksaatti 15 mg/m2 kerran viikossa po.
Kirjallisuutta
Suomen leukemiaryhmän tutkimusprotokolla
Otsikko vaihdettiin muodosta <em class="placeholder">AI-ETI</em> muotoon <em class="placeholder">AI-ETI</em>.
AML2003
- Kirjaudu tai rekisteröidy kommentoidaksesi
AML2003
Sisäänottokriteerit
Ikä 16-65 v, AML WHO kriteerein, potilaan suostumus. Potilastiedotteita ja suostumuslomakkeita on osastoilla, pkl:lla ja tämän sivun alalaidassa liitteenä (attachment)
Poissulkukriteerit
APL, KMLbla, muu sairaus estää voimakkaan hoidon antamisen, raskaus, imetys.
Diagnoosivaiheen tutkimukset
Anamneesi
Selvitetään sekundaarileukemian mahdollisuus, onko potilas saanut säde- tai solunsalpaajahoitoa tai onko hän altistunut erityisen voimakkaasti luuydintä vaurioittaville kemikaaleille tai säteilylle. Selvitetään sisarusten olemassaolo ja heidän terveydentilansa karkeasti. Hoidon toteutumiseen vaikuttavat muut sairaudet, lääkitys ja allergiat.
Status
Kartoitetaan infektio- ja vuototilanne, etsitään taudin ekstramedullaarisia ilmentymiä (imusolmukealueet, perna ja maksa, iho, ikenet, rinnat, kivekset), arvioidaan vitaalielinten tila ja potilaan suorituskyky.
Laboratoriotutkimukset
Akuutin leukemian alkukokeet edellä olevan mukaisesti.
Muut tutkimukset
Vatsan UÄ: pernan ja maksan koko ja rakenne. Thorax-röntgenkuva. Infektioiden kartoitus tilanteen mukaan. EKG. Muut tutkimukset tilanteen mukaan.
Potilaan sisarusten kudostyypitykset
On tärkeää järjestää alle 61-vuotiaiden mahdollisesti allogeniseen siirtoon soveltuvien potilaiden sisarusten HLA-tyypitys nopeasti! Luovuttajaehdokkailla ei saa olla sellaisia vaikeita sairauksia, jotka aiheuttaisivat siirteen luovutuksen yhteydessä riskejä.
Induktio- ja konsolidaatiohoitojen aikaiset tutkimukset
Luuydinnäytteet
Luuytimestä tutkitaan induktiohoidon ja jokaisen konsolidaatiohoidon jälkeen
- Morfologia
- Valittu jäännöstaudin markkeri, jos sellainen on diagnoosivaiheessa löydetty. Jos markkeri tutkitaan kromosomilaboratoriossa, otetaan lisäksi näytettä 7-10 ml kahteen CPT-putkeen mahdollisia myöhemmin tehtäviä täydentäviä tutkimuksia varten (blancho 99999).
- Mononukleaaristen solujen eristys ja mRNA:n eristys kantasolulaboratoriossa (Bm-SoluHem 19465).
Hoitojaksojen yhteydessä arvioidaan:
Neutropenian kesto (< 0,5 x 109/l), trombosytopenian kesto (< 50 x 109/l), korkein CRP, kuumepäivien lukumäärä (³38 oC), sairaalapäivien lukumäärä, huonoin suoriutumiskyky , infektion vaikeusaste, veriviljely-positiiviset infektiot, suolitoksisuus, maksatoksisuus, CNS-toksisuus, ihotoksisuus, muu mahdollinen toksisuus, punasolusiirtojen ja trombosyyttisiirtojen tarve.
Kantasolujen luovuttajan hakeminen
HLA II -näyte sisarus- tai rekisteriluovuttajan hakua varten tutkitaan, jos siirto on aiheellinen riskiryhmäluokituksen ja jos se on mahdollinen allogeenisen siirron edellytysten perusteella. Näyte tutkitaan siirtoikäisiltä potilailta viimeistään ennen toista hoitoa.
Optimaalisen hoitotuloksen kannalta on tärkeää selvittää luovuttajan olemassaolo mahdollisimman nopeasti diagnoosivaiheessa. Ainakin alustavasti tiedon tulisi olla käytettävissä sisarusluovuttajan osalta päivään 28 mennessä (1. HLA-tyypityksen tulos) ja rekisteriluovuttajan osalta päivään 56 mennessä (mahdollisesti sopivia ehdokkaita rekisterissä).
Seurantavaiheen tutkimukset konsolidaatiohoidon päätyttyä
1.- 2. vuosikonsolidaatiohoidon päättymisestä
- täydellinen verenkuva 1 kk välein.
- luuytimen aspiraationäyte 3 kk välein:
- morfologia
- valittu residuaalitaudin markkeri,
- mononukleaaristen solujen eristys ja mRNA:n eristys kantasolulaboratoriossa (Bm-SoluHem 19465).
3. - 5. vuosikonsolidaatiohoidon päättymisestä
- täydellinen verenkuva 4 kk välein.
- 3. vuodesta alkaen luuydin tutkitaan relapsiepäilyn herätessä.
6. - 10. vuosikonsolidaatiohoidon päättymisestä
- täydellinen verenkuva 6 kk välein.
- luuydin tutkitaan relapsiepäilyn herätessä.
Induktiohoidot
- Kirjaudu tai rekisteröidy kommentoidaksesi
Induktiohoidot
Huom!: Randomisaatio IAT tai IdAraC-Ida-hoitoon
1. induktiohoito, randomoitu IAT-hoitoon
Alle 60-vuotiaat potilaat, 9 pv hoito
- Idarubisiini 12 mg/m2 päivinä 1, 3 ja 5, 15 minuutin infuusiona, yhteensä 3 annosta.
- Sytarabiini 50 mg/m2 15 min infuusiona päivänä 1 ja jatkuvana infuusiona 100 mg/m2/vrk päivinä 1 - 9, yhteensä koko hoidossa 950 mg/m2.
- Tioguaniini 75 mg/m2 suun kautta 12 tunnin välein päivinä 1 - 9, yhteensä 18 annosta.
- Sytarabiini- ja tioguaniinihoidon kesto lyhennetään 7 päiväksi, jos potilaalla on vaikea infektio kuten sepsis, lohkokeuhkokuume tms.
|
Lääke |
Annos mg/m2 |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Idarubisiini |
12 |
15 min inf |
x 1 |
1, 3 ja 5 |
|
Sytarabiini |
50 |
nopea inf |
x 1 |
1 |
|
Sytarabiini |
100 |
24 t inf |
jatkuva inf |
1 - 9 |
|
75 |
po. |
x 2 |
1 - 9 |
60 vuotta täyttäneet potilaat, 7 pv hoito
- Idarubisiini 12 mg/m2 päivinä 1, 3 ja 5, 15 minuutin infuusiona, yhteensä 3 annosta.
- Sytarabiini 50 mg/m2 15 min infuusiona päivänä 1 ja jatkuvana infuusiona 100 mg/m2/vrk päivinä 1 - 7, yhteensä koko hoidossa 750 mg/m2.
- Tioguaniini 75 mg/m2 suun kautta 12 tunnin välein päivinä 1 - 7, yhteensä 14 annosta.
|
Lääke |
Annos mg/m2 |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Idarubisiini |
12 |
15 min inf |
x 1 |
1, 3 ja 5 |
|
Sytarabiini |
50 |
nopea inf |
x 1 |
1 |
|
Sytarabiini |
100 |
24 t inf |
jatkuva inf |
1 - 7 |
|
Tioguaniini |
75 |
po. |
x 2 |
1 - 7 |
1. induktiohoito, randomoitu IdAraC-Ida-hoitoon
Alle 60-vuotiaat potilaat, 7 pv hoito
- Sytarabiini 1000 mg/m2 3 tunnin infuusiona x 2 päivinä 1 - 4, yhteensä 8 annosta.
- Idarubisiini 12 mg/m2 15 minuutin infuusiona päivinä 5 - 7, yhteensä 3 annosta.
- Kortikosteroidisilmätipat 1 gtt x 4 kumpaankin silmään päivinä 1 - 4.
|
Lääke |
Annos |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Sytarabiini |
1000 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Idarubisiini |
12 mg/m2 |
15 min inf |
x 1 |
5 - 7 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
60 vuotta täyttäneet potilaat, 6 pv hoito
- Sytarabiini 750 mg/m2 3 tunnin infuusiona x 2 päivinä 1 - 4, yhteensä 8 annosta.
- Idarubisiini 12 mg/m2 infuusiona päivinä 4 – 6, yhteensä 3 annosta.
- Kortikosteroidisilmätipat 1 gtt x 4 kumpaankin silmään päivinä 1 - 4.
|
Lääke |
Annos |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Sytarabiini |
750 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Idarubisiini |
12 mg/m2 |
15 min inf |
x 1 |
4 - 6 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
2. induktiohoito, MEA +/- GO
Toinen induktiohoito annetaan vain niille potilaille, joilla 1. induktiohoidon jälkeen blastien osuus normosellulaarisessa tai hypersellulaarisessa luuytimessä on yli 10 %.
Alle 60-vuotiaat potilaat
- Mitoksantroni 12 mg/m2 30 min iv. infuusiona kerran päivässä päivinä 2 - 5, yhteensä 4 annosta.
- Etoposidi (etoposidifosfaattina) 100 mg/m2 20 minuutin infuusiona kerran päivässä päivinä 1 - 4, yhteensä 4 annosta.
- Sytarabiini 1000 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
- Gemtutsumabi otsogamisiini (GO) potilaan kehon pinta-alan mukaan 5 mg (pinta-ala alle 1,7 m2) tai 10 mg (pinta-ala vähintään 1,7 m2) 2 tunnin infuusiona päivänä 1. GO laimennetaan 100 ml:aan 0,9 % NaCl. GO ei anneta niille potilaille, joille allogeeninen kantasolujensiirto on mahdollinen hoitomuoto.
|
Lääke |
Annos |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Mitoksantroni |
12 mg/m2 |
30 min inf |
x 1 |
2 - 5 |
|
Etoposidi |
100 mg/m2 |
20 min inf |
x 1 |
1 - 4 |
|
Sytarabiini |
1000 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
|
Gemtutsumabi otsogamisiini (MylotargR) jos ei allosiirtoa |
5 mg jos pinta-ala on alle 1,7 m2 10 mg jos pinta-ala on vähintään 1,7 m2 |
2 t inf |
x 1 |
1 |
60 vuotta täyttäneet potilaat
- Mitoksantroni 8 mg/m2 30 min infuusiona kerran päivässä päivinä 2 – 5, yhteensä 4 annosta.
- Etoposidi (etoposidifosfaattina) 100 mg/m2 20 min infuusiona kerran päivässä päivinä 1 – 4, yhteensä 4 annosta.
- Sytarabiini 500 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
- Gemtutsumabi otsogamisiini (GO) potilaan kehon pinta-alan mukaan 5 mg (pinta-ala alle 1,7 m2) tai 10 mg (pinta-ala vähintään 1,7 m2) 2 tunnin infuusiona päivänä 1. GO laimennetaan 100 ml:aan 0,9 % NaCl.
|
Lääke |
Annos |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Mitoksantroni |
8 mg/m2 |
30 min inf |
x 1 |
2 - 5 |
|
Etoposidi |
100 mg/m2 |
20 min inf |
x 1 |
1 - 4 |
|
Sytarabiini |
500 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
|
Gemtutsumabi otsogamisiini (MylotargR) |
5 mg jos pinta-ala on alle 1,7 m2 10 mg jos pinta-ala on vähintään 1,7 m2 |
2 t inf |
x 1 |
1 |
Siirtyminen konsolidaatiohoitoon
Jos 1. tai 2. induktiohoidon jälkeen luuytimen blastien osuus on 10 % tai vähemmän, siirrytään konsolidaatiohoito-ohjelmaan. Jos 2. induktiohoidon jälkeen luuytimen blastien osuus on yli 10 %, jatkohoito annetaan hoitavan lääkärin harkinnan mukaisesti.
Konsolidaatio-keskisuuri riski
- Kirjaudu tai rekisteröidy kommentoidaksesi
Konsolidaatio-keskisuuri riski
Yhteensä annetaan kolme konsolidaatiohoitoa jos allogeenista kantasolujensiirtoa ei tehdä.
Kantasolujensiirto, jäännöstauti, gemtutsumabi otsogamisiini (GO)
- Jos sopiva luovuttaja on olemassa alle 61-vuotiaalle potilaalle, allogeeninen siirto tehdään 1. konsolidaatiohoidon jälkeen jäännöstaudista riippumatta. Jos induktiohoidolla on saavutettu morfologinen remissio, ennen siirtoa annettava 1. konsolidaatiohoito on kevyempi kuin muiden potilaiden 1. konsolidaatiohoito. Hyväkuntoisilla yli 61-vuotiailla potilailla, joilla on tautinsa puolesta hyvin painava indikaatio allogeeniseen siirtoon, se voidaan tehdä kevennettyä esihoitoa käyttäen. Siirtoedellytykset harkitaan yksilöllisesti.
- Jos luovuttajaa ei ole eikä 1. konsolidaatiohoidon jälkeen todeta jäännöstautia, annetaan yhteensä kolme konsolidaatiohoitoa.
- Jos sisarus- eikä rekisterisiirto ole mahdollinen potilaalle, jolla 1. konsolidaatiohodon jälkeen on jäännöstauti, annetaan 2. ja 3. konsolidaatiohoidon yhteydessä GO-hoito.
Kevennetty 1. konsolidaatio allogeeniseen sisarussiirtoon meneville remissiopotilaille
- Sytarabiini 500 mg/m2 3 tunnin iv-infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Idarubisiini 8 mg/m2 15 min iv-infuusiona kerran päivässä päivinä 5 - 6.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
|
Lääke |
Annos |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Sytarabiini |
500 mg/m2 |
3 t inf |
x 2 |
1 – 4 |
|
Idarubisiini |
8 mg/m2 |
15 min inf |
x 1 |
5 – 6 |
|
Kortikosteroidisilmätipat |
1 gtt |
|
x 4 |
1 – 4 |
1. konsolidaatio muille kuin allogeeniseen sisarussiirtoon meneville remissiopotilaille, HDAraC+Ida
Alle 60-vuotiaat potilaat
- Sytarabiini 1500 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Idarubisiini 8 mg/m2 15 minuutin infuusiona kerran päivässä päivinä 5 – 7, yhteensä 3 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
|
Lääke |
Annos |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Sytarabiini |
1500 mg/m2 |
3 t inf |
x 2 |
1 – 4 |
|
Idarubisiini |
8 mg/m2 |
15 min inf |
x 1 |
5 – 7 |
|
Kortikosteroidisilmätipat |
1 gtt |
|
x 4 |
1 – 4 |
Jos 1. konsolidaatiohoidon jälkeen todetaan jäännöstauti, tehdään allogeeninen kantasolujensiirto myös rekisteriluovuttajalta mahdollisuuksien mukaan.
60-vuotta täyttäneet potilaat
- Sytarabiini 750 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Idarubisiini 8 mg/m2 kerran päivässä päivinä 5 – 6, yhteensä 2 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
|
Lääke |
Annos |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Sytarabiini |
750 mg/m2 |
3 t inf |
x 2 |
1 – 4 |
|
Idarubisiini |
8 mg/m2 |
15 min inf |
x 1 |
5 – 6 |
|
Kortikosteroidisilmätipat |
1 gtt |
|
x 4 |
1 – 4 |
2. konsolidaatio, Mito-HDAraC
Alle 60-vuotiaat potilaat
- Mitoksantroni 12 mg/m2 30 minuutin infuusiona, kerran päivässä päivinä 2 – 5, yhteensä 4 annosta.
- Sytarabiini 1500 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
- Jos 1. konsolidaatiohoidon jälkeen todettiin jäännöstauti eikä kantasolujensiirtoon ole mahdollisuutta, annetaan lisäksi gemtutsumabi otsogamisiini 5 mg (pinta-ala alle 1,7 m2) tai 10 mg (pinta-ala vähintään 1,7 m2) 2 tunnin infuusiona päivänä 1.
- Jos 1. konsolidaatiohoidon jälkeen todettiin jäännöstauti tehdään kantasolujensiirto 2. konsolidaation jälkeen mahdollisuuksien mukaan, jos sitä ei tehty 1. konsolidaation jälkeen.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Mitoksantroni |
12 mg/m2 |
30 min inf |
x 1 |
2 – 5 |
|
Sytarabiini |
1500 mg/m2 |
3 t inf |
x 2 |
1 – 4 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 – 4 |
|
Gemtutsumabi otsogamisiini osalle potilaista |
5 tai 10 mg/potilas ks yllä |
2 t inf |
1 |
1 |
60-vuotta täyttäneet potilaat
- Mitoksantroni 8 mg/m2 30 minuutin infuusiona kerran päivässä päivinä 2 – 5, yhteensä 4 annosta.
- Sytarabiini 750 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
- Jos 1. konsolidaatiohoidon jälkeen todettiin jäännöstauti, annetaan lisäksi gemtutsumabi otsogamisiini 5 mg (pinta-ala alle 1,7 m2) tai 10 mg (pinta-ala vähintään 1,7 m2) 2 tunnin infuusiona päivänä 1.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Mitoksantroni |
8 mg/m2 |
30 min inf |
x 1 |
2 – 5 |
|
Sytarabiini |
750 mg/m2 |
3 t inf |
x 2 |
1 – 4 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 – 4 |
|
Gemtutsumabi otsogamisiini osalle potilaista |
5 tai 10 mg/potilas ks yllä |
2 t inf |
1 |
1 |
3. konsolidaatio, MACE
- M-amsakriini 100 mg/m2 kerran päivässä 2 tunnin infuusiona päivinä 1 – 5 yhteensä 5 annosta.
- Sytarabiini 200 mg/m2/vrk jatkuvana infuusiona päivinä 1 - 5. (voidaan keskeyttää etoposidin ja amsakriinin annon ajaksi).
- Etoposidi (etoposidifosfaattina) 100 mg/m2 kerran päivässä 20 minuutin infuusiona päivinä 1 – 5, yhteensä 5 annosta.
Jos 1. konsolidaatiohoidon jälkeen todettiin jäännöstauti eikä kantasolujensiirtoon ole mahdollisuutta, annetaan lisäksi gemtutsumabi otsogamisiini 5 mg (pinta-ala alle 1,7 m2) tai 10 mg (pinta-ala vähintään 1,7 m2) infuusiona päivänä 1.
P-K oltava yli 3,7 ennen amsakriini-hoidon antamista.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Amsakriini |
100 mg/m2 |
2 t inf |
x 1 |
1 – 5 |
|
Sytarabiini |
200 mg/m2 |
24 t inf |
jatkuva inf |
1 – 5 |
|
Etoposidi |
100 mg/m2 |
20 min inf |
x 1 |
1 – 5 |
|
Gemtutsumabi otsogamisiini osalle potilaista |
5 tai 10 mg/potilas ks yllä |
2 t inf |
1 |
1 |
Neuroleukemian profylaksi
Neuroleukemian ennaltaehkäisevä hoito annetaan vain seuraaviin riskiryhmiin kuuluville potilaille:
- Kromosomin 16 inversio
- Akuutti myelomonosyyttileukemia tai monosyyttileukemia (FAB-tyyppi M4 tai M5) ja diagnoosivaiheen B-leuk > 40 x 109/l
- Akuutti myelomonosyyttileukemia tai monosyyttileukemia (FAB-tyyppi M4 tai M5) ja ekstramedullaarinen infiltraatti (mm. iho, imusolmukkeet yli 3 cm, perna).
Remissioon pääsyn jälkeen ja trombosyyttipitoisuuden ollessa yli 40 x 109/l annetaan sytarabiinia intratekaalisesti 100 mg yhteensä 5 annosta. It.-hoitojen väli on vähintään 1 viikko. Iv. ja it. annon välin tulee olla vähintään 48 tuntia, kun iv. infuusiona annettavan sytarabiinin annos on yli 500 mg/m2.
Konsolidaatio-pieni riski
- Kirjaudu tai rekisteröidy kommentoidaksesi
Konsolidaatio-pieni riski
Yhteensä annetaan 3 konsolidaatiohoitoa, joista 2. ja 3. konsolidaatiohoidon annokset ovat pienempiä kuin keskisuuren ja suuren riskin hoidoissa.
Jäännöstauti, kantasolujensiirto, gemtutsumabi otsogamisiini (GO)
Jos todetaan jäännöstauti ennen toista konsolidaatiohoitoa (yli 1 %) tai ennen 3. konsolidaatiohoitoa (yli 0,3 %), tehdään alle 61-vuotiaille potilaille allogeeninen kantasolujensiirto sisarukselta tai rekisteriluovuttajalta mahdollisuuksien mukaan. Hyväkuntoisille yli 61-vuotiaille potilaille, joilla on tautinsa puolesta hyvin painava indikaatio allogeeniseen siirtoon, voidaan se tehdä kevennettyä esihoitoa käyttäen. Siirtoedellytykset harkitaan yksilöllisesti.
Jos ennen 2 konsolidaatiohoitoa todetaan jäännöstauti (yli 0,3 %) eikä allogeeninen siirto ole mahdollinen, annetaan 2. ja 3. konsolidaatiohoito keskiriskin solunsalpaaja-annoksin ja niiden yhteydessä GO-hoito.
1. konsolidaatio HDAraC + Ida
Alle 60-vuotiaat potilaat
- Sytarabiini 1500 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Idarubisiini 8 mg/m2 15 minuutin infuusiona kerran päivässä päivinä 5 – 7, yhteensä 3 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
|
Lääke |
Annos |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Sytarabiini |
1500 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Idarubisiini |
8 mg/m2 |
15 min inf |
x 1 |
5 - 7 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
60-vuotta täyttäneet potilaat
- Sytarabiini 750 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Idarubisiini 8 mg/m2 15 minuutin infuusiona kerran päivässä päivinä 5 - 6.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Sytarabiini |
750 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Idarubisiini |
8 mg/m2 |
15 min inf |
x 1 |
5 - 6 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
2. konsolidaatio Mito-IDAraC
Ennen toista konsolidaatiohoitoa todetun jäännöstaudin vaikutus hoitoon: ks yllä!
Alle 60-vuotiaat potilaat
- Mitoksantroni 12 mg/m2 30 minuutin infuusiona kerran päivässä päivinä 2 - 5.
- Sytarabiini 1000 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1-4.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Mitoksantroni |
12 mg/m2 |
30 min inf |
x 1 |
2 - 5 |
|
Sytarabiini |
1000 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
60-vuotta täyttäneet potilaat
- Mitoksantroni 8 mg/m2 30 minuutin infuusiona kerran päivässä päivinä 2 - 5.
- Sytarabiini 750 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Mitoksantroni |
8 mg/m2 |
30 min inf |
x 1 |
2 - 5 |
|
Sytarabiini |
750 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
3. konsolidaatio MACE
Ennen toista konsolidaatiohoitoa todetun jäännöstaudin vaikutus hoitoon: ks yllä!
- M-amsakriini 100 mg/m2 kerran päivässä 2 tunnin infuusiona päivinä 1 - 4.
- Sytarabiini 100 mg/m2/vrk jatkuvana infuusiona päivinä 1 - 5 (voidaan keskeyttää etoposidin ja amsakriinin annon ajaksi).
- Etoposidi (etoposidifosfaattina) 100 mg/m2 kerran päivässä 20 minuutin infuusiona päivinä 1-5.
- P-K on oltava yli 3,7 ennen amsakriini-hoidon antamista.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Amsakriini |
100 mg/m2 |
2 t inf |
x 1 |
1 – 4 |
|
Sytarabiini |
100 mg/m2 |
jatkuva inf |
jatkuva inf |
1 – 5 |
|
Etoposidi |
100 mg/m2 |
20 min inf |
x 1 |
1 – 5 |
Neuroleukemian profylaksi
Neuroleukemian ennaltaehkäisevä hoito annetaan vain seuraaviin riskiryhmiin kuuluville potilaille:
- Kromosomin 16 inversio
- Akuutti myelomonosyyttileukemia tai monosyyttileukemia (FAB-tyyppi M4 tai M5) ja diagnoosivaiheen B-leuk > 40 x 109/l
- Akuutti myelomonosyyttileukemia tai monosyyttileukemia (FAB-tyyppi M4 tai M5) ja ekstramedullaarinen infiltraatti (mm. iho, imusolmukkeet yli 3 cm, perna).
Remissioon pääsyn jälkeen ja trombosyyttipitoisuuden ollessa yli 40 x 109/l annetaan sytarabiinia intratekaalisesti 100 mg yhteensä 5 annosta. It.-hoitojen väli on vähintään 1 viikko. Iv. ja it. annon välin tulee olla vähintään 48 tuntia, kun iv. infuusiona annettavan sytarabiinin annos on yli 500 mg/m2.
Konsolidaatio-suuri riski
- Kirjaudu tai rekisteröidy kommentoidaksesi
Konsolidaatio-suuri riski
Jäännöstauti, kantasolujensiirto, gemtutsumabiotsogamisiini (GO)
Denovo tai sekundaari leukemia
Jos alle 61-vuotiaalle potilaalle on olemassa luovuttaja, allogeeniseen siirtoon mennään 1. konsolidaatiohoidon jälkeen. Hyväkuntoisilla yli 61-vuotiailla potilailla, joilla on tautinsa puolesta hyvin painava indikaatio allogeeniseen siirtoon, se voidaan tehdä kevennettyä esihoitoa käyttäen. Siirtoedellytykset harkitan yksilöllisesti.
Jos allogeeninen siirto ei ole mahdollinen, potilas saa 4 konsolidaatiohoitoa.
Jos jäännöstauti todetaan 1.konsolidaatiohoidon jälkeen otetussa näytteessä, annetaan 2.- 4. konsolidaatiohoidon yhteydessä gemtutsumabi otsogamisiini -hoito, jos kantasolujensiirtoon ei ole mahdollisuutta.
MDSAML
Allogeeninen siirto tehdään heti kun sen on mahdollista ja blastien osuus on korkeintaan 10 %. Tarvittaessa annetaan ennen siirtoa redusoitu konsolidaatiohoito.
Jos allogeeninen siirto ei ole mahdollinen, annetaan tarpeen mukaan redusoidut konsolidaatiohoidot ohjelman mukaisesti.
1. konsolidaatio, HDAraC-Ida
Alle 60-vuotiaat potilaat
- Sytarabiini 1500 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 – 4, yhteensä 8 annosta.
- Idarubisiini 8 mg/m2 kerran päivässä 15 minuutin infuusiona päivinä 5 – 7, yhteensä 3 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
|
Lääke |
Annos |
Antoaika ja -tapa |
Antokerrat/pv |
Antopäivät |
|
Sytarabiini |
1500 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Idarubisiini |
8 mg/m2 |
15 min inf |
x 1 |
5 - 7 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
Kantasolujensiirto tehdään sisarusluovuttajalta 1. konsolidaatiohoidon jälkeen ja rekisteriluovuttajalta 1. tai 2. konsolidaatiohoidon jälkeen.
60-vuotta täyttäneet potilaat
- Sytarabiini 750 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1-4, yhteensä 8 annosta.
- Idarubisiini 8 mg/m2 kerran päivässä 15 minuutin infuusiona päivinä 5-6, yhteensä 2 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1-4.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Sytarabiini |
750 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Idarubisiini |
8 mg/m2 |
15 min inf |
x 1 |
5 - 6 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
2. konsolidaatio, Mito-HDAraC
Alle 60-vuotiaat potilaat
- Mitoksantroni 12 mg/m2 30 minuutin infuusiona kerran päivässä päivinä 2 - 5.
- Sytarabiini 1500 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
- Jos 1. konsolidaatiohoidon jälkeen todettiin jäännöstauti, annetaan lisäksi gemtutsumabi otsogamisiinia 5 mg (pinta-ala alle 1,7 m2) tai 10 mg (pinta-ala vähintään 1,7 m2) infuusiona päivänä 1, jos allogeeniseen kantasolujensiirtoon ei ole mahdollisuutta.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Mitoksantroni |
12 mg/m2 |
30 min inf |
x 1 |
2 - 5 |
|
Sytarabiini |
1500 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
|
Gemtutsumabi otsogamisiini osalle potilaista |
5 tai 10 mg/potilas ks yllä |
2 t inf |
1 |
1 |
60-vuotta täyttäneet potilaat
- Mitoksantroni 8 mg/m2 30 minuutin infuusiona kerran päivässä päivinä 2 - 5.
- Sytarabiini 750 mg/m2 3 tunnin infuusiona 12 tunnin välein päivinä 1 - 4, yhteensä 8 annosta.
- Kortikosteroidisilmätipat 1gtt x 4/vrk kumpaankin silmään päivinä 1 - 4.
- Jos 1. konsolidaatiohoidon jälkeen todettiin jäännöstauti, annetaan lisäksi gemtutsumabi otsogamisiinia 5 mg (pinta-ala alle 1,7 m2) tai 10 mg (pinta-ala vähintään 1,7 m2) 2 tunnin infuusiona päivänä 1.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Mitoksantroni |
8 mg/m2 |
30 min inf |
x 1 |
2 - 5 |
|
Sytarabiini |
750 mg/m2 |
3 t inf |
x 2 |
1 - 4 |
|
Kortikosteroi-disilmätipat |
1 gtt |
|
x 4 |
1 - 4 |
|
Gemtutsumabi otsogamisiini osalle potilaista |
5 tai 10 mg/potilas ks yllä |
2 t inf |
1 |
1 |
3. konsolidaatio, MACE
- M-amsakriini 100 mg/m2 kerran päivässä 2 tunnin infuusiona päivinä 1-5.
- Sytarabiini 200 mg/m2 /vrk jatkuvana infuusiona päivinä 1-5 (voidaan keskeyttää etoposidin ja amsakriinin annon ajaksi).
- Etoposidi (etoposidifosfaattina) 100 mg/m2 kerran päivässä 20 minuutin infuusiona päivinä 1-5.
Jos 1. konsolidaatiohoidon jälkeen todettiin jäännöstauti, annetaan lisäksi gemtutsumabi otsogamisiinia 5 mg (pinta-ala alle 1,7 m2) tai 10 mg (pinta-ala vähintään 1,7 m2) 2 tunnin infuusiona päivänä 1, jos allogeeniseen kantasolujensiirtoon ei ole mahdollisuutta.
P-K on oltava yli 3,7 ennen amsakriini-hoidon antamista.
|
Lääke |
Annos |
Antoaika ja –tapa |
Antokerrat/pv |
Antopäivät |
|
Amsakriini |
100 mg/m2 |
2 t inf |
x 1 |
1 - 5 |
|
Sytarabiini |
200 mg/m2 |
jatkuva inf |
jatkuva inf |
1 – 5 |
|
Etoposidi |
100 mg/m2 |
20 min inf |
x 1 |
1 – 5 |
|
Gemtutsumabi otsogamisiini osalle potilaista |
5 tai 10 mg/potilas ks yllä |
2 t inf |
1 |
1 |
4. konsolidaatioICE
- Idarubisiini 8 mg/m2 15 minuutin infuusiona päivinä 2 - 4, yhteensä 3 annosta.
- Sytarabiini 200 mg/m2 jatkuvana infuusiona päivinä 1 - 5. Infuusio voidaan keskeyttää etoposidin ja idarubisiinin annon ajaksi.
- Etoposidi (etoposidifosfaattina) 100 mg/m2 20 minuutin infuusiona päivinä 1 – 5, yhteensä 5 annosta.
Jos 1. konsolidaatiohoidon jälkeen todettiin jäännöstauti, annetaan lisäksi gemtutsumabi otsogamisiinia 5 mg (pinta-ala alle 1,7 m2) tai 10 mg (pinta-ala vähintään 1,7 m2) 2 tunnin infuusiona päivänä 1, jos allogeeniseen kantasolujensiirtoon ei ole mahdollisuutta.
|
Lääke |
Annos |
Antoaika |
Antokerrat/pv |
Antopäivät |
|
Idarubisiini |
8 mg/m2 |
15 min inf |
x 1 |
2 – 4 |
|
Sytarabiini |
200 mg/m2 |
24 t inf |
jatkuva inf |
1 - 5 |
|
Etoposidi |
100 mg/m2 |
20 min inf |
x 1 |
1 - 5 |
|
Gemtutsumabi otsogamisiini osalle potilaista |
5 tai 10 mg/potilas ks yllä |
2 t |
x 1 |
1 |
Neuroleukemian profylaksi
Neuroleukemian ennaltaehkäisevä hoito annetaan vain seuraaviin riskiryhmiin kuuluville potilaille:
- Kromosomi 16 inversio
- Akuutti myelomonosyyttileukemia tai monosyyttileukemia (FAB-tyyppi M4 tai M5) ja diagnoosivaiheen B-leuk > 40 x 109/l
- Akuutti myelomonosyyttileukemia tai monosyyttileukemia (FAB-tyyppi M4 tai M5) ja ekstramedullaarinen infiltraatti (mm. iho, imusolmukkeet yli 3 cm, perna).
Remissioon pääsyn jälkeen ja trombosyyttipitoisuuden ollessa yli 40 x 109/l annetaan sytarabiinia intratekaalisesti 100 mg yhteensä 5 annosta. It.-hoitojen väli on vähintään 1 viikko. Iv. ja it. annon välin tulee olla vähintään 48 tuntia, kun iv. infuusiona annettavan sytarabiinin annos on yli 500 mg/m2.
Riskiluokitus
- Kirjaudu tai rekisteröidy kommentoidaksesi
Riskiluokitus
Potilaat jaetaan 1) pienen, 2) keskisuuren ja 3) suuren riskin ryhmiin diagnoosivaiheen löydösten ja ensimmäisen induktiohoidon tuloksen perusteella.
Pieni riski
Pienen riskin ryhmään kuuluvat ne potilaat, joiden kohdalla kaikki alla olevat kriteerit täyttyvät.
- De novo tai sekundaarileukemia
- Karyotyyppi
- t(8;21), inv(16)(p13;q22) tai t(16;16)(p13;q22) ja
- korkeintaan yksi muu poikkeavuus, joka ei saa olla suuren riskin poikkeavuus.
- Muut kriteerit
- Diagnoosivaiheen leukosyyttien pitoisuus on alle 100 x 109/l.
- Diagnoosivaiheessa ei ole ekstramedullaarista leukemiaa.
- Ensimmäisen induktiohoidon jälkeen luuytimen blastien osuus on korkeintaan 10 %.
Keskisuuri riski
Keskisuuren riskin ryhmään kuuluvat ne potilaat, joiden kohdalla kaikki alla olevat kriteerit täyttyvät.
- De novo leukemia
- Karyotyyppi
- normaali tai ei määritettävissä
- +8, -Y, +6, del(12p) tai muu, mutta suureen riskiin kuulumaton poikkeavuus.
- poikkeavuutta lukuun ottamatta pienen ja suuren riskin ryhmään kuuluvia poikkeavuuksia.
- Muut kriteerit
- Diagnoosivaiheessa leukosyyttien pitoisuus on alle 100 x 109/l
- Diagnoosivaihessa ei ole ekstramedullaarisia infiltraatioita (esimerkiksi iholeukemia, keskushermostoleukemia, yli 3 cm läpimittaisia imusolmukkeita, pernan pisin mitta yli 16 cm, useita kloroomia).
- Esimmäisen induktiohoidon jälkeen luuytimen blastien osuus on korkeintaan 10 %.
Suuri riski
De novo tai sekundaarileukemia. Suuren riskin ryhmään kuuluvat ne potilaat, joiden kohdalla yksikin alla olevista kriteereistä täyttyy.
- Karyotyyppi
- 5, del(5q), -7, del(7q), inv(3q), t(3q21-26), poikkeava 11q23, 20q, 21q, 17p, del(9q), t(6;9), t(9;22).
- 3 poikkeavuutta.
- Jokin edellä mainittu suuren riskin poikkeavuus ja lisäksi jokin pienen tai keskisuuren riskin poikkeavuus.
- Sekundaarileukemia, jossa on keskisuuren riskin karyotyyppi, karyotyyppi on normaali tai karyotyyppiä ei ole määritetty.
- Muut kriteerit
- B-leuk diagnoosivaiheessa yli 100 x 109/l.
- Ekstramedullaarinen leukemian manifestaatio.
- Minimaalisesti erilaistunut AML (FAB M0), akuutti erytroleukemia (FAB M6), ja akuutti megakaryosyyttileukemia (FAB M7) sekä akuutti hybridileukemia modifioidun EGIL-luokituksen mukaan.
- Monilinjainen dysplasia WHO:n luokituksen mukaan.
- Ensimmäisen induktiohoidon jälkeen luuytimen blastien osuus on yli 10 %.
- Myelodysplastisen oireyhtymän tai myelodysplastisen myeloproliferatiivisen taudin jälkeen kehittynyt AML. Edellytyksenä on, että perustauti on ollut diagnosoituna 3 kk ennen AML-diagnoosin tekoa.
Epäselvä riski
Jos riskiluokitusta ei voida tehdä tietojen puuttuessa, potilaan katsotaan hoitovalintojen osalta kuuluvan keskisuuren riskin ryhmään.
Otsikko vaihdettiin muodosta <em class="placeholder">Riskiluokitus</em> muotoon <em class="placeholder">Riskiluokitus</em>.
Clo/Cyt/Eto
- Kirjaudu tai rekisteröidy kommentoidaksesi
Clo/Cyt/Eto
Käyttöaiheet
- relapsoitunut tai refraktaari AML tai ALL
Lääkkeet ja annokset
- Klofarabiini 40 mg/m2 iv pv 1-5
- Sytarabiini 1000 mg/m2 iv pv 1-5
- Etoposidi 100 mg/m2 iv pv 1-4
Infuusio-ohjeet
- Jos syklofosfamidi (tai sytarabiini) annostellaan 2 kertaa päivässä:
- klo 9 syklofosfamidi (1 tunnin infuusio) tai sytarabiini (1-3 tunnin infuusio)
- klo 13 etoposidi (15-20 minuutin infuusio)
- klo 16.30 hydrokortisoni 250 mg iv bolus
- klo 17 klofarabiini (1-2 tunnin infuusio)
- klo 21 syklofosfamidi (1 tunnin infuusio) tai sytarabiini (1-3 tunnin infuusio)
- Jos sytarabiini annostellaan kerran päivässä, sytarabiinin infuusio aloitetaan 4 tuntia klofarabiini-infuusion alusta
- klo 10 etoposidi (15-20 min. infuusio)
- klo 11.30 hydrokortisoni 250 mg iv bolus
- klo 12 klofarabiini (1-2 tunnin infuusio)
- klo 16 sytarabiini (1-3 tunnin infuusio)
Muistettavaa
Kirjallisuutta
- Report of a Phase II Study of Clofarabine and Cytarabine in De Novo and Relapsed and Refractory AML Patients and in Selected Elderly Patients at High Risk for Anthracycline Toxicity. Agura E, Cooper B, Holmes H, Vance E, Berryman RB, Maisel C, Li S, Saracino G, Tadic-Ovcina M, Fay J. Oncologist. 2011;16(2):197-206.
| Kirjoittajat: | Kimmo Porkka, Erkki Elonen, Anna Kosola |
FLAG-Ida
- Kirjaudu tai rekisteröidy kommentoidaksesi
FLAG-Ida
Indikaatio
Akuutit leukemiat, relapsin hoito.
Annostelu
|
Lääke |
Annos |
Antotapa |
Antokerrat/pv |
Antopäivät |
Annoksia yhteensä |
|
Idarubisiini |
10 mg/m2, 7 mg/m2 56 v täyttäneille |
15 min inf |
x 1 |
1 ja 3 |
2 |
|
Fludarabiini |
30 mg/m2 |
1 t infusiona 4 t ennen AraC |
x 1 |
1-5 |
5 |
|
Sytarabiini (AraC) |
2000 mg/m2 1000 mg/m2 56 v täyttäneille |
2 tunnin infuusiona 4 t fludarainfuusion lopettamisen jälkeen |
x 1 |
1-5 |
5 |
|
Filgrastiimi |
300 mg/potilas |
sc |
x 1 |
7 ® |
tarpeen mukaan |
Muitakin annosteluja käytetään
Kirjallisuutta
Kompetenznetz 17.1.2004
ICE
- Kirjaudu tai rekisteröidy kommentoidaksesi
ICE
Indikaatiot
- Akuutti myelooinen leukemia. relapsin hoito.
- Krooninen myelooinen leukemia, myelooinen blastikriisi.
Annostelu
- Idarubisiini 8 mg/m2 päivinä 1-5
- Sytarabiini 800 mg/m2 2 tunnin infuusiona päivinä 1-5
- Etoposidi 150 mg/m2 2 tunnin infuusiona päivinä 1-5
- Muitakin annosteluohjeita on samannimiselle hoidolle.
- KML-potilaista osa jää pitkäaikaisesti trombosytopeenisiksi
Kirjallisuutta
Blood 1995; 86 (10) suppl 1: #1615 ASH95 ja #3955 ASH95
Iäkkäiden AML
- Kirjaudu tai rekisteröidy kommentoidaksesi
Iäkkäiden AML
- Useimpia 66 vuotta täyttäneitä AML-potilaita ei voida hoitaa nuorempien hoito-ohjelmien mukaisin täysin annoksin. Monia voidaan kuitenkin hoitaa remissioon pyrkien. Näille potilaille annetaan AML2003 ohjelman hoitoja soveltaen. Granulosyyttikasvutekijän avulla neutropenia-aikaa voidaan lyhentää.
- Iäkkäiden (66 vuotta täyttäneiden) IAT
- IAT induktiohoito voidaan harkinnan mukaan antaa 5-7 päivän mittaisena ja idarubisiiniannoksia voidaan antaa 1-3.
Idarubisiini
- 12 mg/m2 yhtenä, kahtena tai kolmena päivänä (päivät 1, 3 ja 5) 15 minuutin infuusiona, yhteensä 1-3 annosta.
Sytarabiini
- 50 mg/m2 15 min infuusiona päivänä 1 sekä jatkuvana infuusiona 100 mg/m2/vrk alkaen päivänä 1, harkinnan mukaan 5-7 vrk:n ajan.
Tioguaniini
- 75 mg/m2 suun kautta 12 tunnin välein alkaen päivänä 1, harkinnan mukaan 5-7 päivänä, yhteensä 10-14 annosta.
- Jatkohoito riippuu hoitovasteesta ja hoidon siedosta. Usein hoitoa voidaan jatkaa AML2003 konsolidaatiohoidoin modifioiden ja redusoiden.
- Iäkkäiden (66 vuotta täyttäneiden) MEA
- Iäkkäille potilaille soveltuu usein 56 vuotta täyttäneiden MEA-hoito 75-prosenttisin annoksin siten että kutakin lääkettä annetaan kolmena päivänä neljän päivän sijasta.
Mitoksantroni
- 8 mg/m2 30 minuutin inf. päivinä 3 ‑ 5.
Etoposidifosfaatti, annos vastaa etoposidia
- 100 mg/m2 15 - 20 minuutin inf. päivinä 1 ‑ 3. Jos annetaan etoposidia, infuusioaika on 1 tunti.
Sytarabiini
- 400-500 mg/m2 2 tunnin infuusiona 12 tunnin välein päivinä 1 ‑ 3, yhteensä 6 annosta
Jatkohoito riippuu hoitovasteesta ja hoidon siedosta. Usein hoitoa voidaan jatkaa AML2003 konsolidaatiohoidoin modifioiden ja redusoiden.
Kirjallisuutta
Kirjallisuutta
Hoitosuosituksia
- Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Döhner H, Estey EH, Amadori S, Appelbaum FR, Büchner T, Burnett AK, Dombret H, Fenaux P, Grimwade D, Larson RA, Lo-Coco F, Naoe T, Niederwieser D, Ossenkoppele GJ, Sanz MA, Sierra J, Tallman MS, Löwenberg B, Bloomfield CD; European LeukemiaNet. Blood. 2010 Jan 21;115(3):453-74