KLL
KLL
Luokitus: KLL ICD-O 9823/3, ICD-10 C91.1 B-SLL ICD-O 9670/3, ICD-10 C83.00
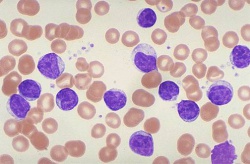 Krooninen lymfaattinen leukemia (KLL) on pahanlaatuinen veritauti, jolle on ominaista morfologisesti kypsien, mutta toiminnaltaan vajavaisten klonaalisten B-lymfosyyttien kertyminen elimistöön: luuytimeen, perifeeriseen vereen, imusolmukkeisiin ja pernaan. Termiä pienilymfosyyttinen lymfooma (SLL) käytetään WHO-luokituksen mukaan niistä KLL-tapauksista, joissa kasvaimen morfologia ja immunofenotyyppi vastaa KLL:aa, mutta perifeerisessä veressä ei todeta lymfosytoosia eikä potilaalla ole sytopenioita.
Krooninen lymfaattinen leukemia (KLL) on pahanlaatuinen veritauti, jolle on ominaista morfologisesti kypsien, mutta toiminnaltaan vajavaisten klonaalisten B-lymfosyyttien kertyminen elimistöön: luuytimeen, perifeeriseen vereen, imusolmukkeisiin ja pernaan. Termiä pienilymfosyyttinen lymfooma (SLL) käytetään WHO-luokituksen mukaan niistä KLL-tapauksista, joissa kasvaimen morfologia ja immunofenotyyppi vastaa KLL:aa, mutta perifeerisessä veressä ei todeta lymfosytoosia eikä potilaalla ole sytopenioita.
KLL on länsimaiden yleisin leukemia ja sen osuus kaikista leukemioista on vajaa kolmannes. Suomessa diagnosoidaan vuosittain n. 150 uutta tapausta. Sairastuneiden mediaani-ikä on 72 vuotta. KLL on heterogeeninen sairaus, jonka kulku vaihtelee indolentista hyvin aggressiiviseen. Sairauden kliinisella vaiheella ja sytogeneettisilla muutoksilla on merkittävä vaikutus ennusteeseen.
KLL todetaan usein sattumalöydöksenä, kun verenkuvassa on todettu leukosytoosi ja lymfosytoosi. Potilas voi hakeutua tutkimuksiin myös imusolmukesuurentumien vuoksi. Yleisoireet kuten väsymys, laihtuminen ja lämpöily liittyvät yleensä pitkälle edenneeseen tautiin. KLL potilailla esiintyy tavanomaista enemmän infektioita.
KLL voidaan diagnosoida perifeerisestä verestä. Immunofenotyypitys on keskeinen osa diagnostiikkaa. Diagnoosivaiheessa on tärkeää erottaa KLL muista lymfoproliferatiivisista sairauksista, kuten prolymfosyyttileukemiasta, lymfoplasmasyyttilymfoomasta, karvasoluleukemiasta, manttelisolulymfoomasta, pernan marginaalivyöhykkseen lymfoomasta, follikulaarisesta lymfoomasta ja LGL-leukemiasta.
| Kirjoittajat: | KLL- ryhmä |
| © Suomen Hematologiyhdistys | Suomen Leukemiaryhmä |
Diagnoosi
Diagnoosi
KLL-diagnoosiin vaaditaan krooninen monoklonaalinen B-lymfosytoosi: Perifeerisessä veressä klonaalisia KLL fenotyypin omaavia B-lymfosyyttejä ≥ 5,0 x 109/L (Poikkeus: ks. SLL). Veren B-lymfosyyttien klonaalisuus tulee varmentaa virtaussytometrialla. Jos lymfosyyteistä >55% on atyyppisiä prolymfosyyttejä, kyseessä on prolymfosyyttileukemia (ks taulukko 1).
Lyhytaikaista (<3kk) tai vähäistä (<5-10 x 10E9/l) lymfosytoosia ei tarvitse tutkia.
Luokittelu
Monoklonaalinen B-lymfosytoosi ( MBL)
Termiä monoklonaalinen B-lymfosyytosi (MBL) käytetään, jos perifeerisessä veressä todetaan klonaalisia, KLL-immunofenotyypin omaavia B-lymfosyyttejä vähemmän kuin 5,0 x 109/L eikä oireettomalla potilaalla ole lymfadenopatiaa, organomegaliaa tai sytopenioita. Monoklonaalisen kloonin tulee olla stabiili 3 kk ajan. MBL voidaan virtaussytometrisesti todeta n. 3-4% väestöstä ja 13-18%:lla KLL-potilaiden 1. asteen sukulaisista.
Jos klonaalisia B-lymfosyyttejä on 0.5 - 4.9 x 109/l, etenemisriski hoitoa vaativaksi KLL:ksi on 1-2% / vuosi.
Jos klonaalisia B-lymfosyyttejä on alle 0.5 x 109/l, tila etenee harvoin KLL:ksi.
Pienilymfosyyttinen lymfooma ( SLL)
Termiä pienilymfosyyttinen lymfooma (SLL) käytetään WHO-luokituksen mukaan niistä KLL-tapauksista, joissa kasvaimen morfologia ja immunofenotyyppi vastaa KLL:aa, mutta perifeerisessä veressä ei todeta lymfosytoosia eikä potilaalla ole sytopenioita. Mikäli potilaalla on luuydininfiltraatiosta johtuvia sytopenioita, dg:ksi voidaan asettaa KLL pienemmillä lymfosyyttimäärillä kuin 5,0 x 109/L.
Familiaalinen KLL
Noin 5%:lla KLL-potilaista on yksi tai useampia sukulaisia, joilla on KLL tai jokin muu lymfoproliferatiivinen sairaus. Silloin KLL luokitellaan familiaariseksi. Se ei eroa sporadisesta taudista kliinisesti tai ennusteen suhteen. KLL potilaiden ensimmäisen asteen sukulaisilla on n. 7-kertainen suhteellinen riski sairastua elämänsä aikana KLL:aan. Absoluuttisesti riski on kuitenkin vain 0.45 %
Diagnoosivaiheen tutkimukset
Anamneesi:
- Yleisoireet: kuumeilu, laihtuminen, yöhikoilu
- Suorituskyky
- Infektiot
- Tuberkuloosialtistus
- Vuoto-oireet
- Sukuanamneesi: lymfoproliferatiiviset sairaudet
Kliininen tutkimus:
- maksan ja pernan koko
- imusolmukestatus
Laboratoriotutkimukset
- B-PVKT+TKD
- B-morfo
- Veren lymfosyyttien immunofenotyypitys
Immunofenotyypitys
KLL:ssä B-lymfosyyteillä on tyypillinen immunofenotyyppi: CD19+, CD20+, CD23+ ja CD5+. Lisäksi B-solut ilmentävät heikosti pintaimmunoglobuliinia (joko kappa tai lambda). Tyypillistä on myös, että CD20 ja CD79b ilmentyvät heikosti ja että CD200 on positiivinen.
Taulukko 1. Lymfosyyyttien solumorfologian ja immunofenotyypin merkitys
(Frater JL, McCarron KF, Hammel JP, Shapiro JL, Miller ML, Tubbs RR, Pettay J, His E. Am J Clin Pathol 2001;116:655-6641)
|
Tauti |
Prolymfos. (%) |
Pieniä ja |
Atyyppisiä lymfos. |
Tyypillinen immunofenotyyppi |
|
KLL |
≤10 |
Ei |
<10 |
CD5+, CD19+, CD20+dim, |
|
KLL/PL
|
>10 ja <55 |
Ei |
- |
Kuten KLL |
|
PL |
≥55 |
Ei |
- |
CD5-/+,CD19+, CD20+, |
|
KLL, sekasoluinen |
≤10 |
Kyllä |
<10 |
Kuten KLL |
|
atyyppinen KLL
|
≤10 |
Ei |
≥10 |
Kuten KLL |
Solumorfologia, joka liittyy prolymfosyyttien tai atyyppisten lymfosyyttien lisääntyneeseen osuuteen, assosioituu sytogeneettisiin poikkeavuuksiin, useimmin trisomia 12 ja del17p ja epäsuotuisaan mutaatiostatukseen (unmutated IgVH status) (Swerlow SH, Campo E, Harris NL, Jaffe ES, Pileci SA, Stein H, Thiele J, Vardiman JW, eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, 4th edn. Lyon, France: International Agency for Research on Cancer (IARC); 2008.) ja progressiiviseen tautiin ja terapialle refraktaarisuuteen (Marionneaux S et al 2014) .
Taulukko 2. CD5 –positiivisten lymfoproliferatiivisten tautien immunofenotyypityksen eroja
|
|
CLL |
MCL |
SMZL |
B PLL |
LPL |
|
CD20 (MFI) |
+ dim |
moderate/ bright |
moderate/ bright |
moderate/ bright |
moderate |
|
CD5 (%) |
80 |
90 |
20 |
30 |
15 |
|
CD23 (%) |
90 |
10 |
20 |
15 |
20 |
|
sIg (MFI) |
dim |
bright |
bright |
bright |
variable |
|
CD79b |
neg/dim |
pos |
pos |
pos |
pos |
MFI = mean fluorescence intensity
% viittaa antigeeniä ilmentävien solujen osuuteen tautitapauksissa
ref. Practical Flow Cytometry in Haematology Diagnosis. First Edition. M. Leach, M. Drummond and A. Doig (2013), Wiley-Blackwell.
Tilanteissa, joissa klonaalisten B-solujen immunofenotyyppi poikkeaa tyypillisestä KLL:n immunofenotyypistä, tutkitaan erotusdiagnostisessa mielessä biopsianäytteen histologia ja immunohistokemialliset tutkimukset . CD23 –negatiivisten tai vahvasti kevytketjuilmentymän omaavien tapausten yhteydessä on tutkittava joko cyklin-D1 tai FISH t(11;14) manttelisolulymfooman osoittamiseksi/poissulkemiseksi. CD23 voi olla positiivinen manttelisolulymfoomassa, mutta CD200 on usein negatiivinen.
Luuydinnäytteet
- Diagnoosivaiheessa luuydinnäytteet eivät yleensä ole tarpeen.
Kuvantamistutkimukset
- harkinnan mukaan/ tarvittaessa thoraxröntgen ja vatsan ultraäänitutkimus
Kantasolujensiirto
- Kirjaudu tai rekisteröidy kommentoidaksesi
Kantasolujensiirto
Päivitetty versio tulossa...
Luokittelu
Luokittelu
Kliininen ennusteluokitus: Binet´n luokitus
Binet’n luokitus perustuu affisioituneiden alueiden lukumäärään, hemoglobiinipitoisuuteen sekä trombosyyttiarvoon. Huomioidaan palpoiden onko lymfadenopatia (> 1 cm läpimittainen imusolmuke) uni- vai bilateraalinen.
Levinneisyysalueet:
1) Pää ja kaula, Waldeyerin rengas mukaan lukien, sisältää yhden alueen vaikka useampi imusolmukeryhmä olisi affisioitunut.
2) Kainalot (molemmat kainalot muodostavat yhden alueen)
3) Nivustaipeet, sisältäen pinnalliset reiden alueet (molemmat nivustaipeet muodostavat yhden alueen)
4) Palpoituva perna
5) Palpoituva maksa (kliinisesti suurentunut)
Luokka A (median survival 12 vuotta)
Hb ≥ 100 g/l, trombosyytit ≥ 100 x 109/l ja tautia korkeintaan kahdella alueella
Luokka B (median survival 7 vuotta)
Hb ≥ 100 g/l, trombosyytit ≥ 100 x 109/l ja tautia kolmella tai useammalla alueella.
Luokka C (median survival 2-4 vuotta)
Kaikki potilaat, levinneisyysalueista riippumatta, joilla Hb on < 100 g/l ja/tai trombosyytit < 100 x 109/l
Anemian ja trombosytopenian KLL:aan liittymättömät syyt on selvitettävä ja hoidettava ennen luokitusta. Myös KLL:aan liittyvät immunosytopeniat on hoidettava ennen kuin luokittelu voidaan tehdä.
Luokittelu
- Kirjaudu tai rekisteröidy kommentoidaksesi
Luokittelu
Kliininen ennusteluokitus
Luokitukset perustuvat palpoituvaan lymfadenopatiaan (>1cm), splenomegaliaan ja hepatomegaliaan sekä alentuneisiin verisoluarvoihin. Vain luuydininfiltraation aiheuttamat sytopeniat huomioidaan luokituksessa. Immunosytopeniat ja muut syyt on hoidettava pois ennen luokituksen tekemistä.
Huomioitava, että molemmissa luokituksissa keskimääräiset eliniät tulevat vanhoista tutkimuksista, joissa ei ole käytetty uusia hoitomuotoja.
Binet´n luokitus
Binet’n luokitus perustuu affisioituneiden alueiden lukumäärään, hemoglobiinipitoisuuteen sekä trombosyyttiarvoon. Huomioidaan palpoiden, onko lymfadenopatia (> 1 cm läpimittainen imusolmuke) uni- vai bilateraalinen.
| Binet luokka | Kliiniset löydökset | med. elossaolo |
| A | Hb ≥100 g/l trombosyytit ≥ 100 x10E9/l suurentuneita imusolmukkeita enintään 2:lla alueella |
12v |
| B | Hb ≥ 100 g/l tromb ≥ 100 x 10E9/l 3 tai enemmän affisioituneita imusolmukealueita |
7v |
| C | Hb < 100 ja/ tai tromb < 100 |
2-4 v |
Levinneisyysalueet:
1) Pää ja kaula, Waldeyerin rengas mukaan lukien, sisältää yhden alueen vaikka useampi imusolmukeryhmä olisi affisioitunut.
2) Kainalot (molemmat kainalot muodostavat yhden alueen)
3) Nivustaipeet, sisältäen pinnalliset reiden alueet (molemmat nivustaipeet muodostavat yhden alueen)
4) Palpoituva perna
5) Palpoituva maksa (kliinisesti suurentunut)
Ennustetekijät
Ennustetta huonontavia kliinisiä tai perusverikokein määritettäviä tekijöitä
- Binet- ja RAI-luokka
- Lymfosyyttien kahdentumisaika < 6kk
- Kohonnut seerumin beta-2-mikroglobuliini
- Kohonnut seerumin tymidiinikinaasi
Ennusteeseen vaikuttavia geneettisiä tekijöitä
IGHV-geenin somaattiset hypermutaatiot eli mutaatiostatus:
Ennustetta heikentävänä tekijänä ei-mutatoitunut IGHV-geeni (”unmutated, U- CLL”). Tauti luokittuu ei-mutatoituneeksi silloin kun IgH-uudelleenjärjestymän IGVH-geenin samankaltaisuus on ≥ 98% ns. ituratasekvenssiin verrattuna.
Mutatoituneessa tautimuodossa (”mutated, M-CLL”) IGHV-geenin samankaltaisuus on < 98% ns. ituratasekvenssiin verrattuna
Huom. Mutatoitumisasteeltaan raja-arvoiselle, 97 — < 98%:n alueelle sijoittuvia tapauksia ei kuitenkaan voida yksiselitteisesti luokitella mutatoituneiksi tai ei-mutatoituneiksi.
Stereotypia:
Klonaalisen IGH-uudelleenjärjestymän kuuluminen johonkin kliinisesti merkittävään stereotyyppiluokkaan #1, #2, #4 tai #8. Näistä luokkaan #4 liittyy suotuisa ennuste, muihin taas aggressiivinen taudinkuva (Stamatopoulos ym. Leukemia 2017)
IGHV3-21-geeni klonaalisen IgH-uudelleenjärjestymän IGVH-geeninä on ennustetta huonontava tekijä jos uudelleenjärjestymä samalla luokittuu stereotypialuokkaan #2. Muussa tapauksessa ennuste määräytyy IGHV-geenin mutaatiostatuksen perusteella. (Baliakas ym. Blood 2015).
Sytogenetiikan löydökset:
Kromosomialueen 13q deleetio on yleisin KLL:ssa tavattu poikkeavuus: se on todettavissa n. 30-50 %:lla KLL-potilaista. Ainoana poikkeavuutena tavattuna 13q deleetio liittyy suotuisaan ennusteeseen.
Kromosomin 12 trisomia todetaan n. 15 %:lla KLL-potilaista. Ennuste jonkin verran heikompi kuin normaalin karyotyypin KLL:ssa
Kromosomin 11 q-varren deleetio on todettavissa n. 10-17 %:lla ja kromosomin 17p-varren deleetio 10-15 %:lla KLL-potilaista.
Sekä 11q- että 17p- deleetiot ovat ennustetta huonontavia löydöksiä. Molemmat muutokset voivat syntyä tautisoluihin myös myöhemmin taudin edetessä.
11q- ja 17p- löydöksiä tavataan useammin mutaatiostatukseltaan ei-mutatoituneessa tautimuodossa. Suotuisamman ennusteen muutokset (13q-deleetio ainoana poikkeavuutena) taas ovat yleisempiä mutatoituneessa taudissa.
Kompleksi karyotyyppi liittyy myös KLL:ssa huonon ennusteeseen.
TP53-geeni sijaitsee kromosomialueella 17p ja sen deleetio ja myös muut mutaatiot heikentävät KLL:n ennustetta. 17p-deleetio / TP53-mutaatio ilmaantuu usein uutena muutoksena taudin edetessä. Tällöin poikkeavuuden yleisyys on voi olla 40-50 %:n luokkaa. Valtaosalla 17p-deleetio tapauksista myös toinen alleeli TP53-geenistä on mutatoitunut. TP53-geeni voi olla mutatoitunut myös tapauksissa, joissa kromosomin 17p- deleetiota ei ole ollut osoitettavissa (yleisyys n. 5 %). Näin ollen normaali tulos FISH-tutkimuksessa ei poissulje TP53-mutaation mahdollisuutta.
17p-deleetio ja TP53-mutaatio ovat merkittäviä myös pienen prosenttiosuuden- ja subklonaalisina löydöksinä.
NOTCH1-geenin mutaatioita todetaan n.5- 10 %:lla KLL-potilaista. NOTCH1-mutaatiot assosioituvat +12-trisomiaan ja IGHV-mutaatiostatukseltaan ei-mutatoituneeseen KLL:aan. NOTCH1-mutaatioihin liittyy suurentunut riski taudin transformaatiolle.
SF3B1-geenin mutaatioita esiintyy 10-15 %:lla KLL-potilaista. SF3B1-mutaatiot liittyvät 11q- kromosomideleetioon ja huonoennusteiseen taudinkuvaan.
Seuranta ja vastearvio
Seuranta ja vastearvio
Seuranta
Kontrollikäynnin tai –kontaktin yhteydessä selvitetään aina
- yleisoireet
- infektioiden esiintyminen
- kliininen tutkimus (imusolmukkeet, perna, maksa)
- täydellinen verenkuva
Pitkäaikaista hoitoa (esim BCR- ja BCL-inhibiittorit) saavien potilaiden haittavaikutukset kysellään tarkoin ja niiden ilmaantumisesta pyydetään ilmoittamaan myös sovittujen kontrollien välissä. Siedettävyyden ja tehon perusteella arvioidaan haittavaikutusten oireenmukaisen hoidon, lääkityksen keskeyttämisen tai annosmuutosten tarve. Jatkuvaa hoitoa saavien potilaiden seuranta tapahtuu hematologiaan perehtyneen lääkärin valvonnassa.
Oireetonta ja pienimassaista (Binet A) KLL:aa seurataan avoterveydenhuollossa. Alkuun kontrolli esimerkiksi 3-4 kk kuluttua ja jos tilanne on rauhallinen, voi kontrollit harventaa 6 -12 kk välein tapahtuvaksi.
Seurantaohje potilaalle ja seurannasta vastaavaan yksikköön
Etenevä tai oireinen (Binet B) vaatii tarkempaa seurantaa 2-4 kk välein ja seuranta tapahtuu joko hematologia konsultoiden avopuolella tai hematologiaan perehtyneen lääkärin toimesta.
Määräaikaisten hoitojen jälkeen vastearvio tehdään hoitavassa yksikössä 2 - 6 kk hoitojen päättymisestä. Hoitojen tavoitteesta ja saavutetusta hoitovasteesta riippuen seuranta voi tapahtua myös avopuolella esimerkiksi aluksi 6 -12 kk välein. Saavutettu hoitovaste korreloi yleensä taudin etenemisvapaan ajan kestoon. Oireiden lisääntyessä seurantaa tihennetään esimerkiksi 3-6 kk välein tapahtuvaksi. Hoitoindikaatioiden täyttyessä uudelleen potilas lähetetään hoitoarvioon hematologiseen yksikköön.
Vastearvio
Vaste annetulle hoidolle arvioidaan aikaisintaan 2 kk (vasta-ainehoidot) ja viimeistään 6 kk hoitojen päättymisestä. Jatkuvien hoitojen yhteydessä hoitovaste arvioidaan hoidon aikana, kun on kulunut vähintään 2 kk parhaimman vasteen saavuttamisesta.
Kliinisessä työssä arvioidaan
aina:
- anamneesi (yleisoireet)
- kliininen tutkimus (imusolmukkeet, perna, maksa)
- täydellinen verenkuva
harkinnan mukaan:
- luuydinaspiraatti / -biopsia: pitkittyneet sytopeniat, joskus CR:n varmistamiseksi
- Thx-rtg ja vatsan / imusolmukealueiden UÄ; jos aluksi poikkeava, epäluotettava palpaatio. Vartalon TT vain erityistapauksissa.
Jäännöstautianalyysi veren virtaussytometrialla toistaiseksi vain tutkimusasetelmissa.
Mukailtu taulukko: IWCLL 2008, M. Hallek et al, Blood 15 June 2008, Vol 111, n:o 12, p. 5451 ja iwCLL 2017 Revised Guidelines
|
|
Täydellinen remissio |
Osittainen hoitovaste |
Progressiivinen tauti |
|
A) Tautimassa: |
|
|
|
|
Imusolmukkeet |
ei yli 1,5 cm |
vähintään 50% pieneneminen/vähenemä |
vähintään 50% kasvu |
|
Pernan koko1 |
normaali (kork.13 cm) |
vähintään 50% pienenemä |
vähintään 50% kasvu |
|
Maksan koko2 |
normaali |
vähintään 50% pienenemä |
vähintään 50% kasvu |
|
B-Lymfosyytit3 |
alle 4,0 x 10E9/l |
vähintään 50% lasku lähtötasosta |
vähintään 50% nousu lähtötasosta |
|
Yleisoireet |
ei yleisoireita |
ei määritelty |
ei määritelty |
|
Luuydin4 |
normaali solukkuus, lymf alle 30%, ei B-lymfosyyttinoduluksia |
50% infiltraatioasteen pienenemä tai B-lymfosyyttinoduluksia |
ei määritelty |
|
B) Hematopoieesi: |
|
|
|
|
Hb |
yli 110 g/l (ilman kasvutekijää tai transfuusioita) |
yli 110 tai vähintään 50% nousu lähtötasosta |
vähintään 20 g/l lasku lähtötasosta (KLL:sta johtuva) |
|
Trom |
yli 100 x 10E9/l |
yli 100 tai vähintään 50% nousu lähtötasosta |
vähintään 50% lasku lähtötasosta (KLL:sta johtuva) |
|
Neutr |
yli 1,5 x 10E9/l |
yli 1,5, tai vähintään 50% nousu lähtötasosta |
ei määritelty |
Stable disease, SD = osittaisen hoitovasteen (PR) eikä tautiprogression (PD) kriteeristö ei täyty
1 Splenomegalia yksistään merkityksetön, jos muut CR:n kriteerit täyttyvät (ainakin MRD neg), 2 Paikalliset ja yleistyneet maksanodulukset huomioitava maksan koon lisäksi, 3 BCR-estäjillä hoidettaessa lääkkeeseen liittyvä lymfosytoosi yksistään ei ole puuttuvan hoitovasteen merkki, 4 CR i= CR:n B-kriteeristö jää vajaaksi tai hyposellulaarinen ydin.
Taudin status (SHR-muuttuja)
Taudin status (SHR-muuttuja)
Vastaa SHR-muuttujaa: status-cll
|
Koodi |
Lyhenne |
Nimike |
Määritelmä |
|
0 |
Dg |
Diagnoosivaihe |
Krooninen monoklonaalinen lymfosytoosi (perifeerisen veren B-lymfosyytit > 5,0 x 109/L) ja korkeintaan 55% lymfosyyteistä voi olla atyyppisiä, prolymfosyyttejä tai lymfoblasteja JA B-lymfosyyteillä on tyypillinen immunofenotyyppi: CD19+, CD20+ (heikko), CD23+, CD5+ (ei muita T-solumarkkereita kuten CD2 tai CD3), CD79b (heikko) |
|
1 |
CR-MRDneg |
Remissio, jäännostauti negatiivinen |
Kaikki seuraavista todettavissa aikaisintaan 2 kk hoidon päättymisestä:
|
|
2 |
CR-MRDpos |
Remissio, jäännostauti positiivinen |
Kaikki seuraavista todettavissa aikaisintaan 2 kk hoidon päättymisestä:
|
|
4 |
CR |
Täydellinen vaste (complete remission) |
Kaikki seuraavista todettavissa aikaisintaan 2 kk hoidon päättymisestä:
|
|
5 |
CRi |
Täydellinen vaste, osittainen toipuminen (complete remission, incomplete recovery) |
Kriteerit kuten CR, paitsi:
|
|
6 |
PR |
Osittainen remissio |
Tilan kesto vähintään 2 kuukautta ja todetaan 1.) ≥ 50% pienentyminen veren lymfosyyttilukemassa 2.) ≥ 50% pienentyminen imusolmukkeissa (joko korkeintaan 6 imusolmukkeen läpimittojen summassa tai suurimman imusolmukepaketin läpimitassa), eikä kasvua missään imusolmukkeessa eikä uusia imusolmukesuurentumia. Alle 2 cm läpimittaisten imusolmukkeiden kohdalla alle 25%:n kasvua ei katsota merkittäväksi. 3.) ≥ 50% pienentyminen hepato- tai splenomegaliassa, siltä osin kuin nämä (kohdat 1,2 ja 3) olivat poikkeavia hoidon alkaessa JA 4.) vähintään yksi seuraavista:
|
|
7 |
SD |
Vakaa tauti (stable disease) |
Potilaat, jotka eivät saavuttaneet CR:a tai PR:a ja joilla ei todeta PD:a |
|
8 |
RD |
Hoidelle vastaamaton tauti (refractory disease) |
Kaikki muut paitsi CR, PR tai SD (myös exitus) 6 kk:n kuluessa antileukeemisen hoidon päättymisestä |
|
9 |
PD |
Etenevä tauti (progressive disease) |
Vähintään YKSI seuraavista:
B-Hb:n lasku > 20 g/L tai B-Hb < 100 g/L TAI B-Trombosyyttien lasku > 50% tai B-Trombosyytit < 100 x 109/L, jos antileukeemisen hoidon päättymisestä on kulunut vähintään 3, mutta alle 6 kk, ja luuydinbiopsiassa todetaan klonaalisia KLL-soluja Sytopenioita ei voida käyttää tautiprogression kriteereinä hoidon aikana. |
|
10 |
Relapsi |
Relapsi |
Relapsi voidaan todeta jos potilas on vähintään 6 kk aiemmin saavuttanut CR:n tai PR:n ja todetaan PD |
|
11 |
Relapsi (neuro) |
Isoloitu neurorelapsi |
|
|
90 |
Exitus-relapsi |
Exitus, relapsi |
|
|
91 |
Exitus-infektio |
Exitus, infektio |
|
|
92 |
Exitus-aplasia |
Exitus, aplasia |
|
|
99 |
Exitus-tuntematon |
Exitus, syy tuntematon |
|
|
999 |
Poistunut seurannasta |
Poistunut seurannasta (lost to follow-up) |
|
Kantasolujensiirto
Kantasolujensiirto
Allogeeninen kantasolujensiirto
Indikaatio:
- hyväkuntoinen (60-(65)-v potilas, jolla todettu KLL:n progressio BCR- tai BCL2- inhibiittorin jälkeen ja jolla on sisarusluovuttaja tai hyvä rekisteriluovuttaja
Kirjallisuutta
Dreger P, Ghia P, Schetelig J, van Gelder M, Kimby E, Michallet M, Moreno C, Robak T, Stilgenbauer S, Montserrat E; ERIC and EBMT. High-risk chronic lymphocytic leukemia in the era of pathway inhibitors: integrating molecular and cellular therapies. Blood 2018;132:892-902.
Kirjallisuutta
Kirjallisuutta
- Binet J-L ym. Perspectives on the use of new diagnostic tools in the treatment of chronic lymphocytic leukemia. Blood 2006, 107: 859-861
- Cazin BF ym. Oral Fludarabine Phosphate and Cyclophosphamide in Previously Untreated CLL: Final Response and Follow-Up in 75 Patients. Blood 2003, 102, abst. 1598
- Hallek M ym. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the InternationalWorkshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute–Working Group 1996 guidelines. Blood 2008, 111: 5446
- Damle RN ym. Ig V Gene Mutation Status and CD38 Expression As Novel Prognostic Indicators in Chronic Lymphocytic Leukemia. Blood 1999, 94: 1840-1847
- Döhner H ym. Genomic Aberrations and Survival in Chronic Lymphocytic Leukemia. N Engl J Med 2000, 343: 1910-1916
- Fischer K ym. Bendamustinein Combination with Rituximab (BR) for Patients with Relapsed Chronic Lymphocytic Leukemia (CLL): A Multicentre Phase II Trial of the German CLL Study Group (GCLLSG).Blood (ASH Annual Meeting Abstracts), Nov 2007; 110: 3106.
- Keating MJ ym. Early Results of a Chemoimmunotherapy Regimen of Fludarabine, Cyclophosphamide, and Rituximab As Initial Therapy for Chronic Lymphocytic Leukemia, J Clin Oncol 2005, 23: 4079-4088
- Keating MJ ym. Management guidelines for use of alemtuzumab in B-cell chronic lympho-cytic leukemia. Clin Lymph 2004, 4: 220-227
- Knauf W ym. BendamustineVersus Chlorambucil in Treatment-Naive Patients with B-Cell Chronic Lymphocytic Leukemia (B-CLL): Results of an International Phase III Study.
- Blood (ASH Annual Meeting Abstracts), Nov 2007; 110: 2043.
- Lamanna N ym. Pentostatin, Cyclophosphamide, and Rituximab Is an Active, Well-Tolerated Regimen for Patients With Previously Treated Chronic Lymphocytic Leukemia. J Clin Oncol 2006, 24:1575-1581
- Lundin J ym. Phase II trial of subcutaneous anti-CD52 monoclonal antibody alemtuzumab (Campath-1H) as first-line treatment for patients with B-cell chronic lymphocytic leukemia (B-CLL). Blood 2002, 100: 768-773
- Moreno C ym. Allogeneic Stem-Cell Transplantation May Overcome the Adverse Prognosis of Unmutated VH Gene in Patients With Chronic Lymphocytic Leukemia. J Clin Oncol 2005, 23: 3433-3438
- Moreton P ym. Eradication of Minimal Residual Disease in B-Cell Chronic Lymphocytic Leukemia After Alem-tuzumab Therapy Is Associated With Prolonged Survival. J Clin Oncol 2005, 23: 2971-2979
- Oscier DG ym. Multivariate analysis of prognostic factors in CLL: clinical stage, IGVH gene mutational status, and loss or mutation of the p53 gene are independent prognostic factors. Blood 2002, 100: 1177-1184
- Rawston AC ym. Quantitation of minimal disease levels in chronic lymphocytic leukemia using a sensitive flow cytometric assay improves the prediction of outcome and can be used to optimize therapy. Blood 2001, 98: 29-35
- Schroers R ym. Combined analysis of ZAP-70 and CD38 expression as a predictor of disease progression in B-cell chronic lymphocytic leukemia. Leukemia 2005, 19: 750-758
- Shanafelt ym. Prognosis at diagnosis: integrating molecular biologic insights into clinical practice for patients with CLL. Blood 2004, 103: 1202-1210
- Sorror ML ym. Hematopoietic Cell Transplantation After Nonmyeloablative Conditioning for Advanced Chronic Lymphocytic Leukemia. J Clin Oncol 2005, 23: 3819-3829
- Thursky KA ym. Spectrum of infection, risk and recommendations for prophylaxis and screening among patients with lymphoproliferative disorders treated with alemtuzumab. Br J Haematol 2006, 132: 2-12
- Wierda WG ym. Novel Immune-Based Treatment Strategies for Chronic Lymphocytic Leukemia. J Clin Oncol 2005, 23: 6325-5332
- PettittARym. Alemtuzumab in combination with high-dose methylprednisolone is a logical, feasible and highly active therapeutic regimen in chronic lymphocytic leukemia patients with p53 defects. Leukemia 2006, 20: 1441-1445
Erityiskysymyksiä
- Kirjaudu tai rekisteröidy kommentoidaksesi
Erityiskysymyksiä
KLL ja immuunisytopeniat
Esiintyvyys
- AIHA 4-10%·
- ITP 2-5 %
-
RCA ( punasoluaplasia) n. 1%
-
immuuni neutropenia, harvinainen alle 1%
Sytopenian yhteydessä poissuljettava muut etiologiset tekijät
-
luuydinnäytteen otto usein indisoitu
-
ei randomoituja tutkimuksia hoidosta
Perusperiaate
- Jos KLL muuten rauhallinen, hoida immuunisytopeniaa samoin periaattein kuin potilailla, joilla ei ole KLL
- Jos hoitovastetta ei saada tai se on lyhyt, KLL:n suunnatut hoidot
AIHA
- 4-10%
- prevalenssi korkeampi edenneessä sairaudessa, mutta voi olla myös KLL ensimmäinen esiintymä
- poissulje muut anemian syyt
- diagnoosi
- Hb tason lasku
- hemolyysitutkimukset : Coombs, bilirubiini, e-retik, LD, haptoglobiini
Hoito
A. Ensilinjan hoidot
- Kortisoni
- Predniso(lo) n 1 (- 1,5 ) mg/ kg po
- kunnes hematologinen vaste, asteittainen vähennys
- vasteet tavallisesti 4 viikon kuluessa. Ellei, mieti muuta hoitoa
- Immunoglobuliini-infuusiot
- 0.4 mg/kg / vrk 5 vrk ajan ( vaihtoehto 1g/kg/vrk 1.-2 pv)
- nopeampi, mutta lyhytkestoinen vaste
- esim.lisänä alkutilanteessa kortisonin rinnalla
- punasolujensiirrot
- kliinisen arvion perusteella
- usein alkuvaiheessa tarpeen kohtuullisen Hb tason saavuttamiseksi
- Sopivuuskokeet hankalia, mutta eivät estä siirtoja
- Muista aktiivi yhteistyö veripalvelun kanssa
B.Toisen linjan hoidot
- rituksimabi
- 375mg/m2 iv kerran viikossa x 4
- splenektomia
muista rokotukset edeltävästi
C. Muut hoitovaihtoehdot
- syklosporiini
- 5-8mg/kg jaettuna kahteen annokseen
- tavoite CyA n. 100
- atsatiopriini
- aloitusannos 1-2 mg/kg
- tarvittaessa nosto ad 2.5mg/kg, ellei 4 vkossa vastetta
D. Tukihoidot
- foolihapposubstituutio
Ellei vastetta tai vaste on lyhytaikainen ; arvio KLL- hoitojen aloittaminen!
ITP
- esiintyvyys 2-5%
- erotusdignostiikassa poissujettava muut trombosytopenian aiheuttajat
hoito
- Ensilinjan ja toisen linjan hodot kuten yllä AIHAn kohdalla
- Kortisonihoitona Prednisolonin sijaan voi vaihtoehtoisesti käyttää Dexametason 40mg x 1 po 4 vrk ajan , toistaen joka toinen viikko
- Muut hoitovaihtoehdot
- TPOanalogit
- eltrombopag
- romiplostiimi
- aineistot pieniä, ei tietoa pitkäaikaisvaikutuksista
- TPOanalogit
RCA ( punasoluaplasia )
- diagnoosi perustuu aina luuydinbiopsiaan
- poissulje
- virusinfektiot mm. parvovirus, CMV ja EBV
- EPO vasta-aineet jos potilas on edeltävästi saanut ESA
Hoito
- punasolujensiirrot
- kortisoni
- immuunosuppressiivinen hoito
- käytetyin syklosporiini
- rituksimabi
- alemtutsumabi ( FIMEAN erityislupavalmiste)
Immuunineutropenia
- isoloitu neutropenia ilman muita muutoksia soluarvoissa
- harvinainen, alle 1%
- Hoito
- kortisoni
- G- CSF
Immuunisytopeniat
- Kirjaudu tai rekisteröidy kommentoidaksesi
Immuunisytopeniat
Yleistä
Esiintyvyys
- AIHA 4-10%·
- ITP 2-5 %
-
RCA ( punasoluaplasia) n. 1%
-
immuuni neutropenia, harvinainen alle 1%
Sytopenian yhteydessä poissuljettava muut etiologiset tekijät
-
luuydinnäytteen otto usein indisoitu
-
ei randomoituja tutkimuksia hoidosta
Perusperiaate
- Jos KLL muuten rauhallinen, hoida immuunisytopeniaa samoin periaattein kuin potilailla, joilla ei ole KLL
- Jos hoitovastetta ei saada tai se on lyhyt, KLL suunnatut hoidot
AIHA
- 4-10%
- prevalenssi suurempi edenneessä sairaudessa, mutta voi olla myös KLL ensimmäinen esiintymä
- poissulje muut anemian syyt
- diagnoosi
- Hb tason lasku
- hemolyysitutkimukset : Coombs, bilirubiini, e-retik, LD, haptoglobiini
Hoito
Ensilinjan hoidot
-
kortisoni
-
Predniso(lo) n 1 (- 1,5 ) mg/ kg po
-
kunnes hematologinen vaste, asteittainen vähennys
-
vasteet tavallisesti 4 viikon kuluessa, ellei mieti muuta hoitoa
Immunoglobuliini-infuusiot
- 0.4 mg/kg / vrk 5 vrk ajan ( vaihtoehto 1g/kg/vrk 1.-2 pv)
- nopeampi, mutta lyhytkestoinen vaste
- esim.lisänä alkutilanteessa kortisonin rinnalla
- punasoluinfuusiot
- kliinisen arvion perusteella
- usein alkuvaiheessa tarpeen kohtuullisen Hb tason saavuttamiseksi
- Sopivuuskokeet hankalia, mutta eivät estä siirtoja
- Muista aktiivi yhteistyö veripalvelun kanssa
Toisen linjan hoidot
· rituksimabi
· 375mg/m2 iv kerran viikossa x 4
· splenektomia
· muista rokotukset edeltävästi
Muut hoitovaihtoehdot
· syklosporiini
· 5-8mg/kg jaettuna kahteen annokseen
· tavoite CyA n. 100
· atsatiopriini
· aloitusannos 1-2 mg/kg
· tarvittaessa nosto ad 2.5mg/kg ,jos 4 viikossa ei vastetta
· Tukihoidot
· Foolihapposubstituutio
- Ellei vastetta tai vaste on lyhytaikainen ; arvio KLL- hoitojen aloittaminen!
ITP
- esiintyvyys 2-5%
- erotusdignostiikassa poissujettava muut trombosytopenian aiheuttajat
- hoito
* Ensilinjan ja toisen linjan hodot kuten yllä AIHAn kohdalla
Kortisonihoitona Prednisolonin sijaan voi vaihtoehtoisesti käyttää Dexametason 40mg po 4 vrk, toistaen joka toinen viikko
* Muut hoitovaihtoehdot
· TPOanalogit
· eltrombopag
· romiplostiimi
· aineistot pieniä, ei tietoa pitkäaikaisvaikutuksista
RCA ( punasoluaplasia )
- diagnoosi perustuu aina luuydinbiopsiaan
- poissulje virusinfektiot mm. parvovirus, CMV ja EBV
- poissulje myös EPO vasta-aineet jos potilas on edeltävästi saanut ESA
- Hoito
· punasolusiirrot
· kortisoni
· immuunosuppressiivinen hoito
· käytetyin syklosporiini
· rituksimabi
· alemtutsumabi ( FIMEAN erityislupavalmiste)
Immuunineutropenia
- isoloitu neutropenia ilman muita muutoksia soluarvoissa
- harvinainen, alle 1%
- Hoito
· kortisoni
· G- CSF
Infektiot
- Kirjaudu tai rekisteröidy kommentoidaksesi
Infektiot
Infektioiden ehkäisy kroonisessa lymfaattisessa leukemiassa
KLL:n hoito valitettavan harvoin korjaa tautiin liittyvää immuunipuutosta. Sen sijaan KLL:n hoito voi – ainakin väliaikaisesti - heikentää immuunipuolustusta. Lääkkeillä voidaan estää herpesinfektioita (asikloviiri, valasikloviiri), pneumocystis jirovecii (PCP)- ja toksoplasmainfektioita (sulfametoksatsoli-trimetopriimi) sekä hepatiitin aktivoitumista (lamivudiini). Bakteeriantibioottiprofylaksiaa ei rutiinisti suositella.
Antimikrobiprofylaksiaa suositellaan seuraavissa tilanteissa:
- kortikosteroidiannos, joka vastaa > 20 mg/vrk Prednisolonia yli kuukauden ajan
- alemtutsumabihoito
- FCR-hoito, bendamustiinihoito. Erityisesti, jos potilaalle ilmaantuu hoidon seurauksena lymfopeniaa (< 1.0 x 109/l), pitkittynyttä neutropeniaa, ikä on > 65v tai on pitkälle edennyt tauti. Aina ei ensilinjan hoidossa ole tarpeen.
- potilas on aiemmin sairastanut pneumocystis-keuhkokuumeen tai anamneesissa on toistuvia herpestulehduksia.
- veren CD4 solut ovat < 0.2 x 109/l
- jos hoitoon tiedetään liittyvän > 3.5% riski PCP-infektioon.
- jos potilas on toksoplasma –seropositiivinen ja CD4+ solut < 0.1 x 109/l, on sulfa-trimetopriimi syytä antaa toksoplasma-annoksella (kts alla)
- jos potilas on hepatiitti-B:n kantaja (HBsAg +, HBV-DNA+)
Mitä ehkäistään ja millä:
- Pneumocystis jirovecii (PCP):
- Sulfametoksatsoli-trimetropriimi (Cotrim *) 1 x 1 joka pv (vaihtoehtoisesti Cotrim forte 1 x1 kolmasti viikossa.)
Huom! Ditrim on sulfadiatsiinia, sen tehosta ei ole näyttöä - Pentamidiini inhalaatiot 100mg 4 viikon välein
- Dapsoni 100 mg x 1 tai atovakoni 1500 mg x 1 joka pv
- Sulfametoksatsoli-trimetropriimi (Cotrim *) 1 x 1 joka pv (vaihtoehtoisesti Cotrim forte 1 x1 kolmasti viikossa.)
- Herpes simplex, varizella zoster:
- Asikloviiri 400mg (800mg) x 2, valasikloviiri 250-500 mg x 2
- Toksoplasma gondii:
- Cotrim forte 1 x 1 joka päivä
- Sytomegalovirus (CMV):
- Alemtutsumabihoidossa suositellaan seuraamaan CMV nukleiinihapon määrää viikoittain. Jos potilaalle tulee oireinen CMV-infektio, alemtutsumabi keskeytetään ja hoidetaan 2-3 viikkoa (val)gansikloviirillä. Alemtutsumabihoito voidaan aloittaa uudelleen kun potilas on oireeton ja CMV-PCR negatiivinen. Oireetonta CMV-reaktivaatiota joko ei hoideta tai vaihtoehtoisesti 1-2 viikkoa hoidetaan, mutta alemtutsumabia saa silloin jatkaa. (Hoitopäätös potilaskohtaisesti, herkästi infektiolääkärin konsultaatio).
- Hepatiitti B:
- Infektiolääkärin konsultaatio.Lamivudiini 100mg x1
Kuinka kauan profylaksiaa jatketaan:
2-6 kk hoidon päättymisestä tai niin kauan kun CD4-solut < 0.2 x 109/l
Immunoglobuliini
Pelkän matalan seerumin immunoglobuliinitason takia ei ole syytä aloittaa immunoglobuliinihoitoa. Hoito on perusteltua, jos seerumin IgG < 3 g/l ja potilaalla on ollut > 2 bakteeri-infektiota edeltävän vuoden aikana.
Iv-annos n. 400 mg / kg 3-4 viikon välein ja tavoitteena on infektioiden häviäminen ja normaali IgG-pitoisuus ennen seuraavaa infuusiota. (Käytetty myös pienempiä annoksia, ruotsalaisten suosituksessa vakioannos 10 g 3 viikon välein.) Mahdollista antaa myös subkutaanisesti (annos n. 50 mg/kg/viikko). Jos infektiot jatkuvat riittävästä substituutiosta huolimatta, hoito lopetetaan.
Rokotukset
Pneumokokkikonjugaatti kaikille mahdollisimman varhaisessa vaiheessa (+/- polysakkaridirokote 2 kk myöhemmin, jos erityisen suuri riski). Influenssarokote syksyisin, syytä antaa myös perheenjäsenille.
Eläviä rokotteita syytä välttää(BCG, oraalinen polio, MPR, salmonella, keltakuume, vesirokko, rotavirus, oraalinen lavantauti). Rokotteita myös syytä välttää aktiivisessa autoimmuunihemolyysivaiheessa, saattaa pahentaa tilannetta.
Hoito
- Kirjaudu tai rekisteröidy kommentoidaksesi
Hoito
Hoidon tavoitteeseen vaikuttaa mm. potilaan kunto ja oletettavissa oleva KLL:sta riippumaton eliniän ennuste. Hyväkuntoisilla (Fit) potilailla hoidon tavoite on täydellinen remissio, jonka on todettu parantavan tautivapaata aikaa ja kokonaiselinaikaa. Huonompikuntoisilla ja iäkkäillä (Slow go) tyydytään oirekontrolliin ja pyritään estämään taudin eteneminen. Hyvin haurailla potilailla tyydytään hyvään oireenmukaiseen hoitoon.
Ennen hoidon aloitusta on tärkeää arvioida potilaan kokonaistilannetta ja kykyä sietää immuno- ja myelosuppressiivista hoitoa. Potilaaseen liittyviä hoidonvalintaan vaikuttavia tekijöitä ovat mm. fyysinen suorituskyky, toimintakyky, ikä, liitännäissairaudet ja niiden hoitoon käytettävät lääkkeet. Myös valittavaan lääkitykseen liittyvät haitta- ja yhteisvaikutukset, potilaan oma mielipide ja valmius sitoutua valittavaan hoitoon on huomioitava hoitoa suunniteltaessa. Jatkuvaksi tarkoitettu lääkehoito keskeytetään / vaihdetaan toiseen taudin edetessä hoidon aikana tai jos hoitoon liittyy hallitsemattomia tai vakavia haittavaikutuksia.
Tärkeimpänä tautiin liittyvänä hoidon valintaan vaikuttavana geneettisenä tekijänä on mahdollinen TP53- geenin toiminnanvajaus (Del(17p) tai TP53 -mutaatio). Myös IGHV-geenin mutaatiostatus vaikuttaa hoidonvalintaan, sillä ei-mutatoituneen tautimuodon on todettu vastaavan huonommin kemoimmunoterapialle, myös ilman todettua TP53-geenin toiminnanvajetta. Vastaavasti mutatoituneessa tautimuodossa ilman TP53-geenin toiminnanvajeeseen johtavia muutoksia voidaan kemoimmunoterapialla saavuttaa pitkäkestoisia remissioita. Kemoimmunoterapiaa ei näissä korkeamman riskin taudeissa suositella, mikäli muita hoitovaihtoehtoja on käytettävissä (korvattavuus).
Arvioi aina, soveltuuko potilas meneillään oleviin hoitotutkimuksiin. Alla listattuna niitä hoitovaihtoehtoja annosteluohjeineen, joilla päivityshetkellä KELA-korvattavuus. Listauksen järjestys ryhmien sisällä ei välttämättä ole ensisijaisuusjärjestys, sillä hoidon valinta tapahtuu lopulta yksilöllisesti kaikki em. asiat huomioiden.
Hyväkuntoisten (fit) hoito
Ensilinjan hoito hyväkuntoisille potilaille, joilla ei ole todettu del 17p/TP53mut
Kemoimmunoterapiavaihtoehdot:
FCR
- rituksimabi C1D0: 375 mg/m2 , C2-6D1: 500mg/m2 iv
- fludarabiini C1-6D1-5: 30 mg/m2 po
- syklofosfamidi C1-6D1-5: 200 mg/m2 po
vaihtoehtoisesti
- rituksimabi C1D0: 375 mg/m2 iv , C2-6D1: 500mg/m2 iv
- fludarabiini C1-6D1-3: 40 mg/m2 po
- syklofosfamidi C1-6D1-3: 250 mg/m2 po
harvoin erityistilanteissa (FC i.v.)
- rituksimabi C1D0: 375 mg/m2 iv , C2-6D1: 500mg/m2 iv
- fludarabiini C1-6D1-3: 25 mg/m2 iv
- syklofosfamidi C1-6D1-3: 250 mg/m2 iv
Syklin pituus 28 päivää. Tavoitteena on kuusi hoitosykliä.
AIHA on vasta-aihe fludarabiinille (Coombs positiivisuuden lisäksi merkkejä hemolyysistä). Seuraa hemolyysikokeita hoitojen aikana. Fludarabiinin takia verituotteet annetaan sädetettyinä.
Yli 65-vuotiaille hyväkuntoisille potilaille suositellaan BR-hoitoa, koska FCR-hoidon toksisuus on huomattava tässä ikäryhmässä. Tämän lisäksi se on suositeltavampi potilaille, joilla on munuaisten vajaatoimintaa (Krea-Cl on alle 60 ml/min).
Bendamustiini + rituksimabi (BR)
- rituksimabi
- C1D0: 375 mg/m2 iv
- C2-6D1: 500 mg/m2 iv
- bendamustiini
- C1-6D1-2: 90 mg/m2 iv
Syklin pituus 28 päivää. Tavoitteena kuusi hoitosykliä.
Kemovapaat vaihtoehdot:
Obinututsumabi + venetoklaksi
(Huom! Tutkimusnäyttö toistaiseksi vain unfit-potilasryhmässä)
- obinututsumabi
- C1: D1 100 mg i.v. ja D2 900 mg i.v.
- C1D8 ja D15: 1000 mg i.v.
- C2-6D1: 1000 mg i.v.
- venetoklaksi
- C1D22 - C2D28: annostitraus (20 mg - 50 mg - 100 mg - 200 mg - 400 mg)
- C3-12: 400 mg x1 p.o.
- 12 hoitojakson määräaikainen hoito
Syklin pituus 28 päivää. Tuumorilyysioireyhtymän ehkäisytoimet valmisteyhteenvedon ohjeen mukaisesti
Ensilinjan hoito hyväkuntoisille potilaille, joilla on todettu del 17p/TP53mut
Ibrutinibi
- Ibrutinibi
- 420 mg x1 p.o.
- jatkuva hoito
Huomioi lisääntynyt riski vuotohäiriöihin ja rytmihäiriöihin sekä mahdollinen verenpaineen nousu
Obinututsumabi + venetoklaksi
- obinututsumabi
- C1: D1 100 mg i.v. ja D2 900 mg i.v.
- C1D8 ja D15: 1000 mg i.v.
- C2-6D1: 1000 mg i.v.
- venetoklaksi
- C1D22 - C2D28: annostitraus (20 mg - 50 mg - 100 mg - 200 mg - 400 mg) 5 viikkoa
- C3-12: 400 mg x1 p.o.
- 12 hoitojakson määräaikainen hoito
Syklin pituus 28 päivää. Tuumorilyysioireyhtymän ehkäisytoimet valmisteyhteenvedon ohjeen mukaisesti
Venetoklaksi
- annostitraus 20 mg - 50 mg - 100 mg - 200 mg - 400mg x1 p.o. valmisteyhteenvedon ohjeen mukaisesti
- jatkuva hoito
- jos B-solureseptoriestäjähoito ei sovellu tai se on epäonnistunut
Huomioi tuumorilyysioireyhtymän ehkäisy, ks.valmisteyhteenveto
Idelalisibi + rituksimabi
- idelalisibi
- 150 mg x2 p.o
- jatkuva hoito
- rituksimabi
- 1.infuusio 375 mg/m2
- 500 mg/m2 iv joka 2.viikko (4 infuusiota)
- 500 mg/m2 iv joka 4.viikko (3 infuusiota)
Ks. idelalisibin valmisteyhteenvedosta infektioprofylaksia ja muut seurantaohjeet sekä toimintaohjeet haittavaikutustilanteissa..
Relapoituneen/refraktaarin KLL:n hoito
Edellinen hoito voidaan uusia, mikäli ensilinjan hoidolla saavutettiin yli 3 vuoden kestoinen remissio. Ellei potilaalla ole jo aiemmin tiedossa olevaa TP53-geenin dysfunktiota, suositellaan tutkittavaksi uudelleen verestä FISH-tutkimus (ja B-TP53-D). Mikäli edellisen hoidon päättymisestä on alle 3 vuotta tai kyseessä on refraktaari KLL, hoitoa vaihdetaan. Katso myös kappale Kantasolujensiirto.
Ibrutinibi
- 420 mg x1 p.o.
- jatkuva hoito
Huomioi lisääntynyt riski vuoto- ja rytmihäiriöihin sekä mahdollinen verenpaineen nousu
Venetoklaksi + rituksimabi
- venetoklaksin
- annostitraus 400 mg:aan x1 ja tuumorilyysioireyhtymän ehkäisy kuten venetoklaksi-monoterapiassa
- 2 vuoden määräaikainen hoito
- rituksimabi
- 4 viikon välein aloitetaan vasta venetoklaksin annosnostovaiheen päätyttyä kun potilas käyttänyt 7 vrk:n ajan annosta 400 mg x1
- 1. infuusio 375 mg/m2 i.v.
- 2.-6. infuusio 500 mg/m2 i.v.
Venetoklaksi
- annostitraus 400 mg:aan x1 p.o. valmisteyhteenvedon ohjeen mukaisesti
- jatkuva hoito
- jos B-solureseptoriestäjähoito ei sovellu tai se on epäonnistunut
Huomioi tuumorilyysioireyhtymän ehkäisy, ks. valmisteyhteenveto
Idelalisibi + rituksimabi
- idelalisibi
- 150 mg x2 p.o.
- jatkuva hoito
- rituksimabi
- 1.infuusio 375 mg/m2
- 500 mg/m2 iv joka 2.viikko (4 infuusiota)
- 500 mg/m2 iv joka 4.viikko (3 infuusiota)
Ks. idelalisibin valmisteyhteenvedosta infektioprofylaksia ja muut seurantaohjeet sekä toimintaohjeet haittavaikutustilanteissa.
Arvioi soveltuuko potilas meneillään oleviin hoitotutkimuksiin.
Kirjallisuutta:
Bouvet E, Borel C, Obéric L, Compaci G, Bruno Cazin B, A-S, Guy Laurent G, Ysebaert L. Impact of dose intensity on outcome of fludarabine, cyclophosphamide, and rituximab regimen given in the first-line therapy for chronic lymphocytic leukemia. Haematologica 2013;98:65-70.
Byrd J, Furman R, Coutre S, Flinn I, Burger J, Kristie A. Blum K, Grant B, Sharman J, Coleman M, Wierda W, Jones J, Zhao W, Heerema N, Johnson A, Sukbuntherng J, Chang B, Clow F, Hedrick E, Buggy J, James D, O'Brien S. Targeting BTK with Ibrutinib in Relapsed Chronic Lymphocytic Leukemia. N Eng J Med NEJM 2014;369:32-42.
Eichhorst B, Fink A-M, Busch R, Lange E, Köppler H, Kiehl M, Sökler M, Schlag R, Vehling-Kaiser U, Köchling G, Plöger C, Gregor M, Plesner T, Trneny M, Fischer K, Döhner H, Kneba M, Wendtner C, Klapper W, Kreuzer K-A, Stilgenbauer S, Böttcher S, Hallek M. Chemoimmunotherapy With Fludarabine (F), Cyclophosphamide (C), and Rituximab (R) (FCR) Versus Bendamustine and Rituximab (BR) In Previously Untreated and Physically Fit Patients (pts) With Advanced Chronic Lymphocytic Leukemia (CLL): Results Of a Planned Interim Analysis Of The CLL10 Trial, An International, Randomized Study Of The German CLL Study Group (GCLLSG). Proc ASH 2014; Abstract 19.
Fischer K, Bahlo J, Fink AM, Goede V, Herling CD, Cramer P, Langerbeins P, von Tresckow J, Engelke A, Maurer C, Kovacs G, Herling M, Tausch E, Kreuzer K-A, Eichhorst B, B ¨ottcher S, Seymour JF, Ghia P, Marlton P, Kneba M, Wendtner C-M, D ¨ohner H, Stilgenbauer S and Mic Hallek M. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: updated results of the CLL8 trial. Blood 2016;127:208-215
Furman R, Sharman J, Coutre S, Cheson B, Pagel J, Hillmen P, Barrientos J, Zelenetz A, Kipps T, Flinn I, Ghia P, Eradat H, Ervin T, Lamanna N, Coiffier B, Pettitt A, Ma S, Stilgenbauer S, Cramer P, Aiello M, Johnson D, Miller L, Li D, Jahn T, Dansey R, Hallek M, O'Brien S. Idelalisib and Rituximab in Relapsed Chronic Lymphocytic Leukemia. N Eng J Med 2014;370:997-1007.
Hamblin TJ, Davis Z, Gardiner A, Oscier DG, Stevenson FK. Unmutated Ig V(H) genes are associated with a more aggressive form of chronic lymphocytic leukemia. Blood 1999;94:1848-1854
Hallek M, Cheson B, Catovsky D, Caligaris-Cappio F, Guillaume Dighiero G, Hartmut Döhner H, Peter Hillmen P, Keating M, Montserrat E, Rai K, Kipps T. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute–Working Group 1996 guidelines. Blood 2008;12:5446-5456.
Hallek M, Fischer K, Fingerle-Rowson G, Fink A, Busch R, Mayer J, Hensel M, Hopfinger G, Hess G, von Grünhagen U, Bergmann M, Catalano J, Zinzani P, Caligaris-Cappio F, Seymour J, Berrebi A, Jäger U, Cazin B, Trneny M, Westermann A, Wendtner C, Eichhorst B, Staib P, Bühler A, Winkler S, Zenz T, Böttcher S,Ritgen M, Mendila M, Kneba M, Döhner H, Stilgenbauer S, on behalf of an international group of investigators and the German Chronic Lymphocytic Leukaemia Study Group. Addition of rituximab to fl udarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet 2010;376:1164-1174.
Hallek M, Cheson BD, Catovsky D, Caligaris-Cappio F, Dighiero G, Döhner H, Hillmen P, Keating M, Montserrat E, Chiorazzi N, Stilgenbauer S. Rai KR, Byrd JC, Eichhorst B, O´Brien S, Robak T, Seymor JF, Kipps TJ. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood. 2018;131(25):2745-2760.
Kater AP, Seymour JF, Hillmen P, Eichhorst B, Langerak AW, Owen C, Verdugo M, Wu J, Punnoose EA, Jiang Y, Wang J, Boyer M, Humphrey K, Mobasher M, and Kipps TJ. Fixed Duration of Venetoclax-Rituximab in Relapsed/Refractory Chronic Lymphocytic Leukemia Eradicates Minimal Residual Disease and Prolongs Survival: Post-Treatment Follow-Up of the MURANO Phase III Study
J Clin Oncol 2019 37:4, 269-277
Seymour JF, Kipps TJ, Eichhorst B, Hillmen P et al. Venetoclax-Rituximab in relapsed or refractory chronic lymphocytic leukemia. NEJM 2018; 378:1107-1120
Stilgenbauer S, Zenz T, Winkler D, Bühler A, Schlenk R F, Groner S, Busch R, Hensel M, Dührsen U, Finke J, Dreger P, Jäger U, Lengfelder E, Hohloch K, Söling U, Schlag R, Kneba M, Hallek M, Döhner H. Subcutaneous Alemtuzumab in Fludarabine-Refractory Chronic Lymphocytic Leukemia: Clinical Results and Prognostic Marker Analyses From the CLL2H Study of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2009;24:3994-4001.
Slow go
1.linjan hoito, joilla ei ole todettu del 17p/TP53mut
Obinututsumabi + klorambusiili
- obinututsumabi
- C1: D1 100 mg, D2 900 mg,
- C1D8 ja D15: 1000 mg iv
- C2-6D1: 1000 mg iv
- varauduttava infuusioreaktioihin, kts. esilääkitys valmisteyhteenvedosta
- klorambusiili
- C1-6D1 ja D15: 0.5 mg/kg p.o.
Sykli 28 vrk
Obinututsumabi + venetoklaksi (Obi-Ven)
- obinututsumabi
- C1: D1 100 mg i.v. ja D2 900 mg i.v.
- C1D8 ja D15: 1000 mg i.v.
- C2-6D1: 1000 mg i.v.
- venetoklaksi
- C1D22 - C2D28: annostitraus (20 mg - 50 mg - 100 mg - 200 mg - 400 mg) 5 viikkoa
- C3-12: 400 mg x1 p.o.
- 12 hoitojakson määräaikainen hoito
Syklin pituus 28 päivää. Tuumorilyysioireyhtymän ehkäisytoimet valmisteyhteenvedon ohjeen mukaisesti
Rituksimabi + bendamustiini
- rituksimabi
- C1D0: 375 mg/m2 iv,
- C2-6D1: 500 mg/m2 iv
- bendamustiini
- C1-6D1-2: 70 - 90 mg/m2 iv
Sykli 28 vrk
Rituksimabi + klorambusiili
(vaihtoehtoinen annostelu suluissa; useita erilaisia annosohjeita)
- rituksimabi
- C3D1: 375 mg/m2 iv pv, C4-8D1:500 mg/m2 iv (tai C1D1 375 mg/m2 ja C2-6D1 500 mg/m2)
- klorambusiili
- C1-6D1-7: 8 mg/m2 (tai C1-6D1-7:10mg/m2)
Sykli 28 vrk
1. linjan hoito, joilla on 17p –deleetio/TP53 -mut
Ibrutinibi
- ibrutinibi
- 420 mg x1 p.o.
- jatkuva hoito
Huomioi lisääntynyt riski vuotohäiriöihin sekä rytmihäiriöihin sekä mahdollinen verenpaineen nousu
Obinututsumabi + venetoklaksi
- obinututsumabi
- C1: D1 100 mg i.v. ja D2 900 mg i.v.
- C1D8 ja D15: 1000 mg i.v.
- C2-6D1: 1000 mg i.v.
- venetoklaksi
- C1D22 - C2D28: annostitraus (20 mg - 50 mg - 100 mg - 200 mg - 400 mg) 5 viikkoa
- C3-12: 400 mg x1 p.o.
- 12 hoitojakson määräaikainen hoito
Syklin pituus 28 päivää. Tuumorilyysioireyhtymän ehkäisytoimet valmisteyhteenvedon ohjeen mukaisesti
Venetoklaksi
- annostitraus 400 mg:aan x1 p.o. valmisteyhteenvedon ohjeen mukaisesti
- jatkuva hoito
- jos B-solureseptoriestäjähoito ei sovellu tai se on epäonnistunut
Huomioi tuumorilyysioireyhtymän ehkäisy, ks. valmisteyhteenveto
Idelalisibi + rituksimabi
- idelalisibi
- 150 mg x2 p.o.
- jatkuva hoito
- rituksimabi
- 1.infuusio 375 mg/m2
- 500 mg/m2 joka 2.viikko (4 infuusiota)
- 500 mg/m2 joka 4.viikko (3 infuusiota)
Kts.idelalisibin valmisteyhteenvedosta tarvittava infektioprofylaksia ja muut seurantaohjeet sekä toimintaohjeet haittavaikutustilanteissa.
Relapsin hoito
- hoitovaste kestänyt yli 3 vuotta: edellinen hoito voidaan uusia
- hoitovaste kestänyt alle 3 vuotta: hoidon vaihto
- FCR-hoitojen toistamista ei kuitenkaan suositella kumulatiivisiin annoksiin liittyvän lisääntyneen MDS-riskin vuoksi
Ibrutinibi
- Ibrutinibi
- 420 mg x1 p.o.
- jatkuva hoito
Huomioi lisääntynyt riski vuotohäiriöihin sekä rytmihäiriöihin sekä mahdollinen verenpaineen nousu
Rituksimabi + Venetoklaksi
-
venetoklaksi
-
annostitraus 400 mg:aan x1 ja tuumorilyysioireyhtymän ehkäisy kuten venetoklaksi-monoterapiassa
-
-
rituksimabi
-
aloitetaan vasta venetoklaksin annosnostovaiheen päätyttyä kun potilas käyttänyt 7 vrk:n ajan annosta 400 mg x1
-
C2D8: 1. infuusio 375 mg/m2 i.v.
-
2.-6. infuusio 500 mg/m2 i.v., 4 viikon välein
-
Venetoklaksi
- annostitraus 400 mg:aan x1 p.o. valmisteyhteenvedon ohjeen mukaisesti
- jatkuva hoito
- jos B-solureseptoriestäjähoito ei sovellu tai se on epäonnistunut
Huomioi tuumorilyysioireyhtymän ehkäisy, ks. valmisteyhteenveto
Idelalisibi + rituksimabi
- idelalisibi
- 150 mg x2 p.o.
- jatkuva hoito
- rituksimabi
- 1.infuusio 375 mg/m2
- 500 mg/m2 joka 2.viikko (4 infuusiota)
- 500 mg/m2 joka 4.viikko (3 infuusiota)
Kts.idelalisibin valmisteyhteenvedosta infektioprofylaksia ja muut seurantaohjeet sekä toimintaohjeet haittavaikutustilanteissa.
Kirjallisuutta:
Byrd JC, Furman RR, Coutre SE, Flinn IW, Burger JA, Blum KA, Grant B, Sharman JP, Coleman M, Wierda WG, Jones JA, Zhao W, Heerema NA, Johnson AJ, Sukbuntherng J, Chang BY, Clow F, Hedrick E, Buggy JJ, James DF, O´Brien S. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013;369:32-42.
Cortelezzi A, Sciume M, Liberati AM, Vincenti D, Cuneo A, Reda G, Laurenti L, Zaja F, Marasca R, Chiarenza A, Gritti G, Orsucci L, Storti S, Angelucci E, Cascavilla N, Gobbi M, Mauro FR, Morabito F, Fabris S, Piciocchi A, Vignetti M, Neri A, Rossi D, Giannarelli D, Guarini A, Foa R. Bendamustine in combination with Ofatumumab in relapsed or refractory chronic lymphocytic leukemia: a GIMEMA Multicenter Phase II Trial. Leukemia 2014;28:642-8.
Fischer K, Cramer P, Busch R, Böttcher S, Bahlo J, Schubert J, Pfluger K, Schott S, Goede V, Isfort S, von Tresckow J, Fink A-M, Buhler A, Winkler D, Kreuzer K-A, Staib P, Ritgen M, Kneba M, Dohner H, Eichhorst BF, Hallek M, Stilgenbauer S, Wendtner C-M. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: A multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2012;30:3209-16.
Fischer K, Cramer P, Busch R, Stilgenbauer S, Bahlo J, Schweighofer CD, Bottcher S, Staib P, Kiehl M, Eckart MJ, Kranz G, Goede V, Elter T, Buhler A, Winkler D, Kneba M, Dohner H, Eichhorst BF, Hallek M, Wendtner C-M. Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: A multicenter phase II trial of German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2011;29:3559-66.
Fischer K, Othman A, Bahlo J, Fink A-M, Tandon M, Dixon M, Robrecht S, Warburton S, Humhrey K, Samoylova O, Liberati A, Pinilla-Ibarz J, et al. Venetoclax and Obinutuzumab in Patients with CLL and Coexisting Conditions. N Engl J Med 2019; 380:2225-2236
Foa R, Del Giudice I, Cuneo A, Del Poeta G, Ciolli S, Di Raimondo F, Lauria F, Cencini E, Matteo Rigolin G, Cortelezzi A, Nobile F, Callea V, Brugiatelli M, Massaia M, Molica S, Trentin L, Rizzi R, Specchia G, Di Serio F, Orsucci L, Ambrosetti A, Montillo M, Luigi Zinzani P, Ferrara F, Morabito F, Angela Mura M, Soriani S, Peragine N, Tavolaro S, Bonina S, Marinelli M, Stefania De Propris M, Della Starza I, Piciocchi A, Alietti A, Runggaldier EJ, Gamba E, Romana Mauro F, Chiaretti S, Guarini A. Chlorambucil plus rituximab with or without maintenance rituximab as first-line treatment for elderly chronic lymphocytic leukemia patients. Am J Hematol 2014 Jan 11. doi:10.1002/ajh.23668 [Epud ahead of print].
Foon KA, Boyiadzis M, Land SR, Marks S, Raptis A, Pietragallo L, Meisner D, Laman A, Sulecki M, Butchko A, Schaefer P, Lenzer D, Tarhini A. Chemoimmunotherapy with low-dose fludarabine and cyclophosphamide and high dose rituximab in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol 2009;27:498-503.
Furman RR, Sharman JP, Coutre SE, Cheson BD, Pagel JM, Hillmen P, Barrientos JC, Zelenetz AD, Kipps TJ, Flinn I, Ghia P, Eradat H, Ervin T, Lamanna N, Coiffier B, Pettitt AR, Ma S, Stilgenbauer S, Cramer P, Aiello M, Johnson DM, Miller LL, Li D, Jahn TM, Dansey RD, Hallek M, O´Brien SM. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014;370:997-1007.
Goede V, Fischer K, Busch R, Engelke A, Eichhorst B, Wendtner CM, Chagorova T, de la Serna J, Dilhuydy MS, Illmer T, Opat S, Owen CJ, Samoylova O, Kreuzer KA, Stilgenbauer S, Döhner H, Langerak AW, Ritgen M, Kneba M, Asikanius E, Humphrey K, Wenger M, Hallek M. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014;370:1101-10.
Hallek M. Chronic lymphocytic leukemia: 2013 Update on diagnosis, risk stratification and treatment. Am J Hematol 2015;90:446-60.
Hillmen P, Robak T, Janssens A, Babu KG, Kloczko J, Grosicki S, Doubek M, Panagiotidis P, Kimby E, Schuh A, Pettitt AR, Boyd T, Montillo M, Gupta IV, Wright O, Dixon I, Carey JL, Chang CN, Lisby S, McKeown A, Offner F; COMPLEMENT 1 Study Investigators. Chlorambucil plus ofatumumab versus chlorambucil alone in previously untreated patients with chronic lymphocytic leukaemia (COMPLEMENT 1): a randomised, multicentre, open-label phase 3 trial. Lancet 2015;385:1873-83.
O´Brien S, Furman RR, Coutre SE, Sharman JP, Burger JA, Blum KA, Grant B, Richards DA, Coleman M, Wierda WG, Jones JA, Zhao W, Heerema NA, Johnson AJ, Izumi R, Hamdy A, Chang BY, Graef T, Clow F, Buggy JJ, James DF, Byrd JC. Ibrutinib as initial therapy for elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. Lancet Oncol 2014;15:48-58.
Wierda WG, Kipps TJ, Mayer J, Stilgenbauer S, Williams CD, Hellmann A, Robak T, Furman RR, Hillmen P, Trneny M, Dyer MJ, Padmanabhan S, Piotrowska M, Kozak T, Chan G, Davis R, Losic N, Wilms J, Russell CA, Osterborg A; Hx-CD20-406 Study Investigators. Ofatumumab as single-agent CD20 immunotherapy in fludarabine-refractory chronic lymphocytic leukemia. J Clin Oncol 2010;28:1749-55.
Kansainvälisiä hoitosuosituksia:
Saksa 2020: Chronische Lymphatische Leukämie (CLL) — Onkopedia
Ruotsi 2020: Nationellt vårdprogram Kronisk lymfatisk leukemi (KLL) (cancercentrum.se)
ESMO 2020: Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up (annalsofoncology.org)
NCCN 2019: https://www.nccn.org/professionals/physician_gls/default.aspx
BSH 2018: https://onlinelibrary.wiley.com/doi/epdf/10.1111/bjh.15460
iwCLL 2018: https://doi.org/10.1182/blood-2017-09-806398
Ennen hoitoa
- Kirjaudu tai rekisteröidy kommentoidaksesi
Ennen hoitoa
Otsikko vaihdettiin muodosta <em class="placeholder">Ennen hoitoa</em> muotoon <em class="placeholder">Ennen hoitoa</em>.
Hoidon indikaatiot
- Kirjaudu tai rekisteröidy kommentoidaksesi
Hoidon indikaatiot
Otsikko vaihdettiin muodosta <em class="placeholder">Hoidon indikaatiot</em> muotoon <em class="placeholder">Hoidon indikaatiot</em>.
Hoidon indikaatiot
- Kirjaudu tai rekisteröidy kommentoidaksesi
Hoidon indikaatiot
- Oireetonta Binet A ja B-luokan tautia voidaan usein seurata.
- Koska valkosolujen aggregaatioon liittyviä oireita harvemmiin tulee KLL -potilaille,
ei absoluuttista lymfosyyttitasoa pidetä yksittäisenä hoidon aloituksen aiheena
Hoidon aloituksen indikaatiot
- IWCLL suositus
1. Etenevä luuytimen toiminnan heikkeneminen:
- paheneva anemia ja/tai trombosytopenia
2. Huomattava splenomegalia
- perna ainakin 6 cm kylkikaaren alapuolelle
- etenevä tai oireinen splenomegalia
3. Huomattava lymfadenopatia
- imusolmukkeen läpimitta > 10 cm
- etenevä tai oireinen lymfadenopatia
4. Etenevä veren absoluuttinen lymfosytoosi
- yli 50% nousu 2 kk aikana tai
- lymfosyyttien määrän kaksinkertaistuminen ( LDT) 6 kk aikana
- LDT : Ei tilanteissa, joissa alkuvaiheen lymf < 30 x10E9/l
5. Huonosti kortikosteroidille tai muulle käypä hoidolle reagoiva AIHA tai ITP
6. Tautiin liittyvät yleisoireet
- tahaton vähintään 10% painonlasku viimeisen 6 kk aikana
- merkittävänä väsymys ( ECOG 2 tai huonompi)
- kuumetta vähintään 38.0 ainakin 2 vkon ajan ilman osoitusta infektiosta
- vähintänä 1 kk ajan esiintynyt yöhikoilu
.
Tutkimukset ennen hoitoa
- Kirjaudu tai rekisteröidy kommentoidaksesi
Tutkimukset ennen hoitoa
Laboratoriokokeet
- B-PVK+TKD
- E-Retik
- B-La
- P-CRP
- P-K, P-Na
- P-Krea
- P-Uraat
- P-Gluk
- P-ALAT, P-AFOS, P-Bil
- P-LD
- P-Ca-albk/P-Ca-ion
- E-ABORh
- E-Coomb-O
- S-Prot-Fr
- S-B2Miglo
- S-HIVAgAb, S-HBsAg, HBcAb, S-HCVAb, S-CMVAb
Luuydinnäytteet
- harkinnan mukaan
Sytogeneettiset tutkimukset
- FISH menetelmällä veren lymfosyyteistä
- 13q-deleetio
- 11q-deleetio
- 17p-deleetio ja
- trisomia 12.
- TP53 mutaatiostatuksen tutkimista suositellaan sellaisilta potilailta, joilla ei todeta 17p-deleetiolta.
- Sytogenetiikka tulee tutkia myös uusiutuneen taudin hoidon alkaessa, koska 17p-deleetio / TP53-mutaatio ilmaantuu usein taudin edetessä.
- IGHV- mutaatiostatus (B/Bm-IgSHM-D) tutkitaan kertaalleen (tulos muuttumaton) aktiivisen hoidon piirissä olevilta potilailta.
Kuvantamistutkimukset
- Ennen hoitoa kaikista potilaista otetaan thorax-röntgen ja vatsan UÄ.
- Vain erityistilanteissa tutkitaan vartalon TT-kuvaus, josta aiheutuva säderasitus on merkittävä.
Imusolmukkeen histologinen tutkimus
- Jos herää epäily taudin transformaatiosta, tulee suurentunut imusolmuke poistaa tuorenäytteeksi patologille. Edustavan imusolmukkeen valinnassa voi PET-TT olla hyödyllinen.
KLL:n seurantaohje
- Kirjaudu tai rekisteröidy kommentoidaksesi
KLL:n seurantaohje
Oireetonta ja pienimassaista KLL:aa seurataan ilman lääkehoitoja jopa vuosien ajan ja osalla tauti ei koskaan etene oireiseksi. Oireetonta tai vähäoireista tautia ei hoideta, koska hoidoista aiheutuisi enemmän haittaa kuin itse taudista. Liian varhaisen hoidonaloituksen ei ole todettu parantavan potilaan kokonaisennustetta. Useimmilla tauti kuitenkin etenee hitaasti ja on hyödyllistä seurata taudin etenemistä harvakseltaan mahdollisten hoidon aloituksen tarpeen ja komplikaatioiden varalta. Annettujen hoitojen jälkeen päästään usein vuosia kestävään oireettomaan vaiheeseen, jolloin seuranta tapahtuu samaan tapaan. Seuranta voi tapahtua avoterveydenhuollossa esimerkiksi kerran tai kaksi vuodessa.
Kontrollikäyntien yhteydessä
- kysytään yleisoireilusta (yleiskunnon muutokset, tahaton laihtuminen, infektioiden esiintyminen, yöhikoilu, kuumeilu)
- tehdään kliininen tutkimus: palpoidaan imusolmukealueet eli kaula, kainalot, nivusalueet ja arvioidaan pernan ja maksan koko
- tarkistetaan täydellinen verenkuva, TVK
Hoidon aloituksen aiheita ovat
- KLL:aan liittyvä anemisoituminen (Hb alle 110 g/l tai lasku 20g/l) tai trombosytopenia (B-Trom alle 100 x 10E9/l)
- erittäin kookas tai nopeasti kasvava perna, joka aiheuttaa oireita
- erittäin runsaat, oireita aiheuttavat tai nopeasti lisääntyvät imusolmukesuurentumat
- nopeasti lisääntyvä lymfosytoosi ( B-Lymf kaksinkertaistuu 6 kk:ssa tai nousu +50% 2 kk:ssa lähtötason ollessa yli 30). Pelkästään korkea, hitaasti nouseva/tasainen lymfosyyttitaso ei ole hoidon aihe, ellei siihen liity hyperviskositeettia
- kortikosteroidille reagoimaton autoimmuunihemolyyttinen anemia (AIHA) tai immunologinen trombosytopenia (ITP)
- voimakas yleisoireisuus
- tahaton laihtuminen (vähintään 10% painosta)
- selittämätön, voimakas ja toimintakykyä heikentävä väsymys
- kuumeilu yli 38C ilman infektiota vähintään 2 viikon ajan
- voimakas yöhikoilu vähintään 1 kk:n ajan ilman infektiota
KLL:aan liittyy lisääntynyt infektioherkkyys, jonka vuoksi kaikille suositellaan vuosittaista influenssarokotetta ja yleensä myös pneumokokkirokotetta.
Autoimmuunisytopeniat (AIHA ja ITP) liittyvät yleisesti KLL:aan. Yleensä ne reagoivat hyvin kortisonihoidolle.
Mikäli potilas on oireinen tai tauti osoittaa nopean etenemisen merkkejä tai siihen liittyy hankalia komplikaatioita, kannattaa hematologia konsultoida.
Valikon tekstit korjattu