Myelooma
- Kirjaudu tai rekisteröidy kommentoidaksesi
Myelooma
 Luokitus: ICD-O 9732/3, ICD-10 C90.0
Luokitus: ICD-O 9732/3, ICD-10 C90.0
Myelooma on pahanlaatuinen verisairaus, plasmasolusyöpä, joka saa alkunsa luuytimen B-solujen malignisoituneesta plasmasolukloonista. Myeloomasolun terve vastinsolu on monenlaisia immunoglobuliineja, vasta-aineita, tuottava B-solulinjan kypsä plasmasolu. Sairastunut plasmasoluklooni tuottaa vain yhdenlaista immunoglobuliinia, jota kutsutaan nimella monoklonaalinen proteiini, M-komponentti tai paraproteiini. Paraproteiini muodostuu yleensä immunoglobuliinin raskas- ja kevytketjusta, mutta noin 15-20% myeloomista erittää pelkästään kevytketjua; kappaa tai lambdaa. IgG-myeloomia on noin 50%, IgA-myeloomia 20%, loput 10% ovat harvinaisia IgD- tai non-sekretorisia myeloomia tai plasmasoluleukemioita. Kevytketjumyelooma voi johtaa munuaisten vajaatoimintaan ja korkea M-komponentti veressä voi aiheuttaa hyperviskositeettioireita. Luuytimessä paikallisesti lisääntyvä myeloomasolukko aiheuttaa multippeleita lyyttisiä luustopesäkkeitä (multippeli myelooma), luustokipua ja jopa patologisia murtumia. Myös paikallisia plasmasolukasvaimia, plasmasytoomia, voi esiintyä luuytimen ulkopuolellakin.
Euroopassa todetaan noin 23 000 uutta tapausta vuodessa, Suomessa ilmaantuvuus on 4,7/100 000/vuosi. Myelooma muodostaa 1% kaikista syövistä ja 10-15% hematologisista syövistä. Myeloomapotilas on keskimäärin 68-70 vuotias taudin toteamishetkellä. Myelooman syy ei ole tiedossa, vaikka useita myeloomassa esiintyviä kromosomimuutoksia jo tunnetaan. Kyseessä ei ole periytyvä sairaus, mutta joissain harvoissa tapauksissa saman perheen ja suvun jäseniltä löytyy erilaisia B-solusarjan pahanlaatuisia veritauteja (Waldenströmin tauti, myelooma, KLL).
Myelooman diagnoosi perustuu luuydinlöydökseen ja paraproteiinin osoittamiseen, mutta myelooman oireisuus ratkaisee hoidon aloituksen.
| Kirjoittajat: | Raija Silvennoinen, Mervi Putkonen, Tarja-Terttu Pelliniemi, Marjaana Säily, Pekka Anttila, Kari Remes, Pia Niittymäki SLR:n myeloomaryhmä |
| © Suomen Hematologiyhdistys | Suomen Leukemiaryhmä |
Diagnoosi
Diagnoosi
Myelooman diagnoosi ja hoidonaloituskriteerit ovat uudistuneet syksyllä 2014. Aiemmin vain CRAB-kriteerien mukaan oireiset potilaat katsottiin hoitoa vaativiksi (myelooman aiheuttama hyperkalsemia, munuaisten vajaatoiminta, anemia, luustotauti). Uuteen kriteeristöön on otettu kolme uutta biomarkkeria, joiden täyttyessä riski kahden vuoden aikana taudilla edetä hoitoa vaativaksi myeloomaksi on niin suuri, että hoidon aloitus on aiheellinen. Myös muutamia muita muutoksia on tehty, mm. myelooman diagnoosi ei enää edellytä paraproteiinin löytymistä. Lisäksi CRAB-kriteereitä on täsmennetty, mm. osteoporoosia ei enää lasketa luustotaudin kriteereihin ja kreatiniinin rinnalle on otettu eGFR munuaisfunktion arviossa.
Uudistuneet diagnoosi ja hoidonaloituskriteerit löytyvät kohdasta plasmasolutaudit.
Diagnoosivaiheen tutkimukset, jotka suositellaan tehtäviksi kaikille
Veri- ja virtsatutkimukset:
TVK, ABORhD, CRP, kalium, natrium, kreatiniini, albumiini, S-Ca, S-Ca-ion, fosfaatti, ALAT, AFOS, bilirubiini, uraatti, LD, beeta2mikroglobuliini, PLV, S- ja dU-proteiinifraktiot (elektroforeesit), S- ja dU- immunofiksaatiot, S-vapaat kevytketjut ja näiden suhde (S-IgLc-V), P-IgG, P-IgA, P-IgM.
Muista myös harvinainen IgD-myelooma (P-IgD, immunofiksaatio IgD- vasta-aineilla) ellei paraproteiinia ala löytyä.
Kuvantamistutkimukset:
Matala-annoksinen luuston TT-kuvaus on ensisijainen kuvantamismenetelmä niissä yksiköissä, joissa se on saatavilla. Luuston TT-kuvaus tehdään ilman varjoainetta, joten kreatiniinillä ei merkitystä.
- Poikkeuksena mikäli diagnoosivaiheessa todetaan ekstramedullaarinen eli luuston ulkopuolinen plasmasytooma (luuston plasmasytoomaan liittyvää pehmytkudoskasvua ei lasketa), niin tällöin perinteinen varjoainetehosteinen vartalon TT-kuvaus on kuitenkin ensisijainen, sillä matala-annoksisen luuston TT-kuvauksen erotuskyky ei riitä ekstramedullaaristen plasmasytoomien toteamiseen.
Niissä yksiköissä, joissa matala-annoksinen luuston TT-kuvaus ei saatavilla käytetään ensisijaisesti edelleen perinteisiä luuston natiivikuvia (kallo, lantio, kaula-, rinta- ja lanneranka, pitkät luut). Perinteiset luustokuvat on hyviä pitkien luiden ja kallon osalta, mutta niiden kyky havaita lantion ja selkärangan lyyttiset muutokset on selvästi heikompi kuin TT-menetelmällä.
Mikäli luuydinnäytteiden ja luuston kuvauksen (luuston TT tai perinteisen luustokuvat) jälkeen jää vaikutelma smoldering myeloomassa, niin lantion ja selkärangan MRI on pakollinen, jotta pystytään erottelemaan smoldering myelooma hoitoa vaativasta multippelista myeloomasta (ks. plasmasolutautien diagnoosikriteerit). Magneettikuvaus osoittaa herkästi pehmytkudosmuutokset, selkäydinkompression ja patologisen luuydininfiltraation. Selkäydinkompressio-oireet ovat indikaatio päivystysmagneettikuvaukselle. MRI pystyy lisäksi erottelemaan benignin osteoporoosin (ja benignin osteoporoottisen murtuman) myelooman aiheuttamasta osteoporoosista (jos MRI:n luuydinsignaali on normaali, niin kyseessä on benigni osteoporoosi).
PET-TT ei kuulu myelooman rutiinikuvantamiseen. Sitä voidaan kuitenkin erityistapauksissa harkita, esimerkkinä non-sekretorinen hoitoa vaativa myelooma, jossa muulla menetelmällä luustotauti osoitettu. Huomioitava, että PET tulkintaa ei ole myeloomassa standardoitu, tutkimukseen voi liittyä vääriä positiivisia löydöksiä, kaikki myeloomaleesiot eivät merkkiainetta kerää, eikä PET kuulu myelooman virallisiin vastearviokriteereihin.
Hammaslääkäri:
Hampaiston tarkistus ja saneeraus on tarpeen ennen luustolääkityksen aloitusta, ks. tukihoidot. OPTG.
Luuydintutkimukset:
Luuydin aspiraatin ja luuydinbiopsian morfologia. Plasmasolujen klonaliteetti voidaan osoittaa luuydinbiopsiasta immunohistokemiallisesti. Mikäli luuydinbiopsiaa ei oteta, tulee virtaussytometria tutkia plasmasolujen klonaaliteetin osoittamiseksi. Virtaussytometrian rooli jäännöstautianalytiikassa on kasvava, ja näin ollen virtaussytometrian tutkiminen intensiivihoitoon soveltuvilta on muutenkin suositeltavaa.
Perinteistä kromosomitutkimusta (G-raita-analyysi) ei enää suositella käytettävän (Suomen myeloomaryhmän päätös 5.11.2015) sen vähäisen informatiivisuuden vuoksi.
Sytogeneettiset tutkimukset tehdään interfaasi FISH tutkimuksella CD138 valikoiduista plasmasoluista. Seuraavat muutokset on liitetty huonompaan ennusteeseen: del(17p) (jos kloonin suuruus 60% tai suurempi), t(4;14), t(14;16), t(14;20), 1q ylimäärä ja del(1p32). Sytogenetiikkaa käytetään riskiarvioinnissa, sillä ei ole merkitystä diagnoosin asettamisessa.
Biopankki näytteet (FHRB) tutkimustarkoitukseen voidaan ottaa halukkailta.
Diagnoosivaiheen tutkimukset, jotka suositellaan tehtäviksi niille potilaille (< 70 v), joille suunnitellaan autologista tai allogeenista intensiivihoitoa
Yllä mainittujen tutkimusten lisäksi:
E-Coombs, hepatiitti-, HIV- ja kuppaserologiat, HLAI-tyypitys (allogeeninen intensiivihoito)
crab
crab
C Hyperkalsemia: s-ca >2,75 mmol/l
R Munuaisten vajaatoiminta: s-krea > 177 umol/l
A Anemia: normokrominen, normosytäärinen anemia, Hb <100 g/l tai laskenut 20 g/l alle normaalin viitealueen
B Luustomuutokset: lyyttiset pesäkkeet, vaikea osteopenia tai patologiset murtumat
Luokittelu
- Kirjaudu tai rekisteröidy kommentoidaksesi
Luokittelu
Durie-Salmon
Durie-Salmon
Vaikeusaste I
Myeloomasolukon määrä on alle 0,6 x 1012 solua/m2. Kaikki alla mainitut kriteerit täyttyvät:
- Hb yli 100 g/l
- S-Ca alle 3,0 mmol/l (normaali)
- Luuston röntgenlöydös on normaali tai todetaan vain yksi osteolyyttinen pesäke
- M-komponentin määrä:
- S-IgG pienempi kuin 50 g/l
- S-IgA pienempi kuin 30 g/l
- Virtsassa pienempi kuin 4 g/vrk
Vaikeusaste II
Myeloomasolukon määrä 0,6 – 1,2 x 1012 solua/m2.
Ne myeloomat, jotka eivät sovi vaikeusasteeseen I tai III.
Vaikeusaste III
Myeloomasolukon määrä yli 1,2 x 1012 solua/m2. Myelooma täyttää yhden tai useampia seuraavista kriteereistä:
- Hb alle 85 g/l
- S-Ca yli 3,00 mmol/l
- Laajat lyyttiset luustomuutokset
- Suuri M-komponentti:
- IgG suurempi kuin 70 g/l
- IgA suurempi kuin 50 g/l
- Virtsassa suurempi kuin 12 g/vrk
Ryhmät A ja B
Vaikeusasteet I, II ja III jaetaan ryhmiin A ja B munuaisfunktion perusteella:
A) P-Krea on < 176 μmol/l
B) P-Krea on ≥176 μmol/l
Durie BG, Salmon SE. A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment, and survival. Cancer. 1975, 36(3):842-54.
IMWG riskiluokitus
- Kirjaudu tai rekisteröidy kommentoidaksesi
IMWG riskiluokitus
| Suuri riski (high-risk) | Standardiriski (Standard-risk) | Pieni riski (Low-risk) | |
| Muuttujat |
|
Muut |
|
| Mediaani OS | 2 vuotta | 7 vuotta | >10 vuotta |
| % potilaista | 20 % | 60 % | 20 % |
Viitteet: Chng WJ, IMWG consensus on risk stratification in multiple myeloma, Leukemia 2014; 28: 269-27
ISS ja R-ISS
ISS ja R-ISS
ISS
International stageing system (ISS) for multiple myeloma - vaikeusasteen kriteerit
Vaikeusaste |
Ennustetekijät |
Mediaanielinaika (kk) |
|
1 |
B2M < 3,5mg/l ja albumiini ≥ 35g/l |
62 |
|
2 |
B2M < 3,5mg/l ja albumiini < 35g/l tai B2M 3,5 – 5,4 mg/l |
44 |
|
3 |
B2M ≥5,5 mg/l |
29 |
Greipp PR, San Miguel J, Durie BG, Crowley JJ, Barlogie B, Blade J, Boccadoro M, Child JA, Avet-Loiseau H, Kyle RA, Lahuerta JJ, Ludwig H, Morgan G, Powles R, Shimizu K, Shustik C, Sonneveld P, Tosi P, Turesson I, Westin J. International staging system for multiple myeloma. J Clin Oncol. 2005 May 20;23(15):3412-20.
Revised ISS (R-ISS)
| Vaikeusaste | Kriteerit | Mediaanielinaika (kk) | |
| R-ISS 1 |
|
Ei saavutettu | |
| R-ISS 2 | Ei R-ISS 1 tai R-ISS 3 | 83 | |
| R-ISS 3 |
|
43 | |
Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised International Staging System for Multiple Myeloma: A Report From International Myeloma Working Group. J Clin Oncol. 2015 Sep 10;33(26):2863-9.
Mitattava tauti
- Kirjaudu tai rekisteröidy kommentoidaksesi
Mitattava tauti
Myelooman hoitoa aloitettaessa arvioidaan onko tauti mitattavissa (measurable) ja millaisella mittarilla.
Mitattavissa olevan taudin (measurable) määritelmä (vuokaavio):
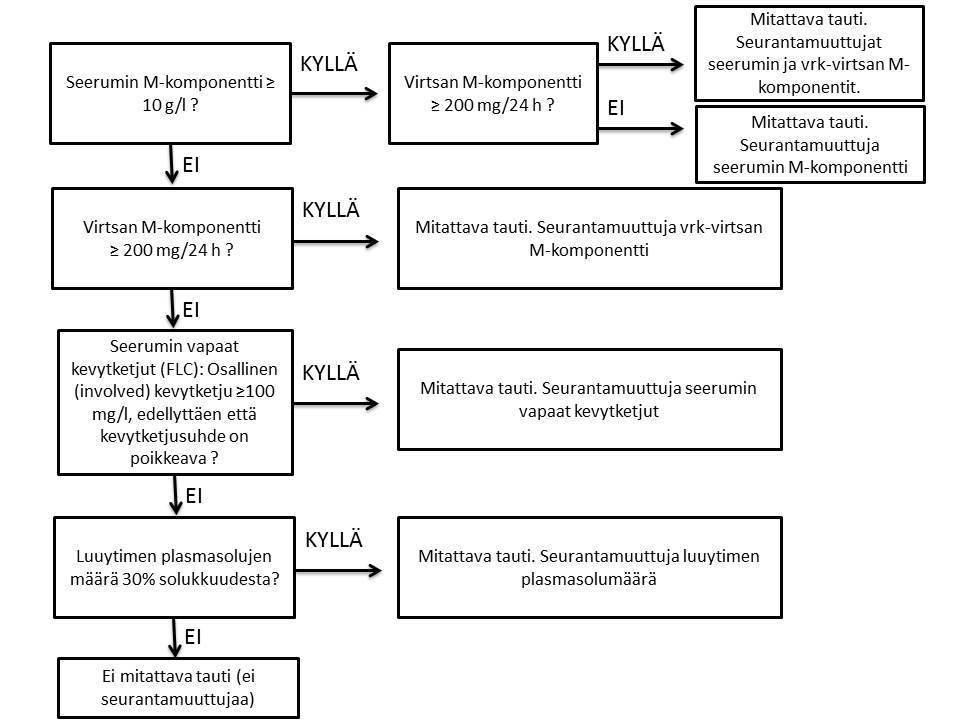
*Luuydinaffiisio tulisi mieluiten arvioida luuydinbiopsialla; jos aspiraatissa ja biopsiassa on epäsuhta käytetään näistä korkeampaa arvoa. Virtaussytometriaa ei käytetä plasmasolumäärän arviointiin.
Mikäli tauti ei ole mitattavissa, vastearviona voidaan käyttää vain täydellistä remissiota (CR) tai sitä syvempää vastetta, sekä progressiivista tautia (PD).
Mikäli hoidon alussa seerumissa (tai virtsassa) M-komponentissa on useampi piikki, niin niiden summaa käytetään vasteen arvioimiseen.
Plasmasolutaudit (luokittelu)
Plasmasolutaudit (luokittelu)
Non-IgM monoklonaalinen gammapatia (Non-IgM monoclonal gammopathy of undetermined significance, Non-IgM MGUS)
Kaikkien kolmen kriteerin on täytyttävä:
• Seerumin monoklonaalinen proteiini (non-IgM) < 30 g/l
• Luuytimessä klonaalisia plasmasoluja < 10 %
• Ei merkkejä kohde-elinvaurioista (CRAB), amyloidoosista
IgM monoklonaalinen gammapatia (IgM MGUS)
Kaikkien kolmen kriteerin on täytyttävä:
• Seerumin IgM monoklonaalinen proteiini < 30 g/l
• Luuytimessä lymfoplasmasyyttinen infiltraatio < 10 %
• Ei merkkejä anemiasta, yleisoireista, hyperviskositeetista, lymfadenopatiasta, hepatosplenomegaliasta, tai muusta lymfoproliferatiivisen taudin aiheuttamasta pääte-elinvauriosta
Kevytketjujen monoklonaalinen gammapatia (Light-chain MGUS)
Kaikkien kriteerien on täytyttävä:
- Poikkeava seerumin vapaiden kevytketjujen suhde ja osallisen (involved) kevytketjun määrä yli viitearvojen ylärajan absoluuttisesti
- Ei immunoglobuliinin raskasketjua immunofiksaatiossa
- Ei merkkejä kohde-elinvaurioista (CRAB), amyloidoosista
- Luuytimessä klonaalisia plasmasoluja < 10 %
- Virtsan monoklonaalinen kevytketjueritys < 500 mg/24h
Smoldering myelooma (ei hoitoa vaativa myelooma) (Smoldering multiple myeloma)
Molempien kriteerien täytyttävä:
• Seerumin monoklonaalinen proteiini (IgG tai IgA) ≥ 30 g/l (tai virtsan monoklonaalinen proteiini ≥ 500 mg/24h) ja/tai luuytimessä klonaalisia plasmasoluja 10-60 % JA
• Ei plasmasolusairaudesta johtuvia kohde-elinvaurioita (CRAB), eikä myeloomaa määrittäviä biomarkkereita, eikä amyloidoosia.
Multippeli myelooma (hoitoa vaativa myelooma) (Multiple myeloma)
Molempien kriteerien on täytyttävä:
• Luuytimessä klonaalisia (virtaussytometria tai immunohistokemia) plasmasoluja ≥ 10% TAI biopsialla osoitettu ekstramedullaarinen plasmasytooma
• Plasmasolutaudista johtuva kohde-elinvaurion löydös (CRAB) TAI jokin myeloomaa määrittävä biomarkkeri:
CRAB - kriteerit:
- Hyperkalsemia: seerumin kalsium > 2.75 mmol/l
- Munuaisten vajaatoiminta: seerumin kreatiniini > 177 µmol/l tai eGFR < 40 ml/min
- Anemia (Hb < 100 g/l tai Hb vähintään 20 g/l laboratorion viitearvoja matalampi) (Suomalaiset viitealueet hemoglobiinille; naiset 117 – 155 g/l, miehet 134 – 167 g/l)
- Luustomuutokset: yksi tai useampi lyyttinen pesäke luuston natiivikuvissa tai TT:ssä (jokaisen tulee olla läpimitaltaan vähintään 5 mm) (jos luuytimessä on < 10% plasmasoluja vaaditaan enemmän kuin yksi lyyttinen leesio solitaarin plasmasytooman jossa matala luuydinaffiisio ja multippelin myelooman erotteluksi).
Myeloomaa määrittävät biomarkkerit:
- klonaalisten plasmasolujen osuus luuytimessä ≥60% (jos epäsuhta luuydinaspiraatin ja -biopsian välillä lasketaan näistä korkeampi arvo)
- osallisten/ei-osallisten (involved/uninvolved) seerumin vapaiden kevytketjujen suhde ≥100 (osallisten kevytketjujen oltava vähintään 100 mg/l absoluuttisesti)
- >1 fokaalileesio MRI:ssä (läpimitaltaan vähintään 5 mm)
Solitaarinen plasmasytooma (Solitary plasmacytoma)
Kaikkien neljän kriteerin täytyttävä
• Yksittäinen biopsialla todennettu luun tai pehmytkudoksen kasvain, jossa klonaalisia plasmasoluja
• Luuydinlöydös klonaalisia plasmasoluja < 10%
(solitaari plasmasytooma jaotellaan luuydinlöydöksen perusteella kahteen entiteettiin: solitaariseen plasmasytoomaan jossa ei lainkaan klonaalisia plasmasoluja luuytimessä sekä solitaariseen plasmasytomaan, jossa minimaalinen luuydinaffiisio <10%)
• Normaali luuston natiivikuvaus sekä selkärangan ja lantion magneettikuvaus (tai TT) (paitsi primaari leesio)
• Ei kohde-elinvaurion merkkejä (CRAB)
Plasmasoluleukemia
Jommankumman kriteerin on täytyttävä:
• Veren valkosoluista > 20 % muodostuu plasmasoluista ja /tai
• Veren plasmasolujen absoluuttinen määrä > 2 x 10E9/l
Systeeminen AL – amyloidoosi (Systemic AL amyloidosis)
Kaikkien neljän kriteerin täytyttävä
• Amyloidin kertymiseen liittyvä poikkeava kliininen oire tai löydös, esim. munuaisten, maksan, sydämen, mahasuolikanavan tai perifeerisen hermoston taholta
• Kudoksesta amyloidivärjäys (Kongopunavärjäys) positiivinen (esim. rasva-aspiraatti, ihon stanssibiopsia, luuydin tai elinbiopsia)
• Immunohistokemiallinen värjäys tai muu menetelmä, joka osoittaa amyloidin olevan kevytketjuamyloidia
• Osoitus monoklonaalisesta plasmasolusairaudesta; seerumin tai virtsan M-proteiini, poikkeava seerumin vapaiden kevytketjujen suhde tai klonaalisia plasmasoluja luuytimessä
POEMS
Diagnoosi edellyttää molempia pakollisia (mandatory) kriteereitä sekä yhtä 3:sta major kriteeristä ja yhtä 6:sta minor kriteeristä.
Pakolliset (mandatory) Major kriteerit (molemmat vaaditaan)
- Polyneuropatia
- Monoklonaalinen plasmasolutauti (lähes aina lambda)
Muut Major kriteerit (1 vaaditaan)
- Castlemanin tauti
- Skleroottiset luustomuutokset
- S/P-VEGF koholla (raja-arvoa ei ole määritetty; IMWG suosittelee että olisi ainakin 3-4 kertaa yli laboratorion viitearvojen ylärajan jotta laskettaisiin major kriteeriksi)
Minor kriteerit (1 vaaditaan)
- Organomegalia (splenomegalia, hepatomegalia, lymfadenopatia)
- Ekstravaskulaarinen nestelasti (turvotus, pleuraneste, askites)
- Endokrinopatia (lisämunuainen, kilpirauhanen, hypofyysi, hypogonadismi, haima, lisäkilpirauhanen); diabetesta tai hypotyreoosia ei lasketa
- Ihomuutokset (hyperpigmentaatio, hypertrichosis, akrosyanoosi, flush, valkoiset kynnet)
- papillaödeema
- Trombosytoosi/polysytemia
Ilmiöillä on oltava ajallinen yhteys, eikä niille saa löytyä muita aiheuttajia. Diagnoosin oikeellisuutta tulee epäillä, mikäli osteoskleroottista pesäkkeitä ei löydy. Sairaudessa nähdään usein myös trombosytoosi ja kohonnut seerumin tai plasman VEGF (vascular endothelial growth factor) – pitoisuus. Suomessa S-VEGF – määritys ei ole kliinisessä rutiinikäytössä, mutta tutkimusta voi tiedustella Göteborgista: Göteborgs Universitet Wallenberglaboratoriet (Göteborg university Wallenberg laboratory for Cardiovascular Research), yhdyshenkilö Associate professor Lillemor Mattsson Hulten, s-posti Lillemor.Mattsson@wlab.gu.se
Laboratoriokeskuksen yleislähete, johon pyynnöksi S - VEGF. Hinta on 340 SEK/näyte.
Viitteet: Rajkumar SV, Dimopoulos MA, Palumbo A et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014 Nov; 15(12): e538-48.
Seuranta ja vastearvio
Seuranta ja vastearvio
- M-komponentti on useimmiten paras taudin aktiviteetin mittari. Induktiohoidon yhteydessä se kannattaa tutkia jokaisen hoidon jälkeen juuri ennen seuraavaa hoitoa.
- Kevytketjumyelooman hoitovasteen mittari on vuorokaudessa erittyvä M-komponentti (dU-prot-fr).
- S-IgLc-V –määritystä voidaan käyttää kevytketjumyelooman seurannassa ja joidenkin non-sekretoristen myeloomien seurannassa.
- Plasman immunoglobuliinitasoja (lähinnä P-IgA, P-IgM ja P-IgD) voidaan käyttää, jos M-komponentti erottuu huonosti proteiinifraktioinnissa.
Taudin status
Taudin status
SHR-muuttuja: status_mm
Standardi IMWG vastearvio kriteerit
|
Lyhenne |
Nimike |
Määritelmä |
|
Dg |
Diagnoosivaihe Diagnosis |
|
|
sCR |
Stringent complete response Täydellinen vaste lisäehdoin |
|
|
CR |
Complete response Täydellinen vaste |
|
|
VGPR |
Very good partial respomse Erittäin hyvä osittainen vaste |
|
|
PR |
Partial response Osittainen vaste |
|
| MR |
Minimal response Minimaalinen vaste |
|
|
SD |
Stable disease Stabiili tauti |
|
|
PD |
Progressive disease Progressiivinen tauti |
TAI
TAI
TAI
|
|
Clinical relapse |
Kliininen relapsi |
|
| Relapse from complete response (CR) |
Relapsi täydellisestä vasteesta (CR) |
|
|
Relapse from MRD |
Relapsi MRD negatiivisuudesta |
|
| Exitus | Exitus |
IMWG MRD kriteerit (edellyttää CR)
| Sustained MRD-negative | Kestävä MRD-negatiivinen |
|
| Flow MRD-negative | Virtaus MRD-negatiivinen |
|
| Sequencing MRD-negative |
Sekvensointi MRD-negatiivinen |
|
| Imaging-positive MRD-negative |
Kuvantamis-vahvistettu MRD-negatiivinen |
|
Huomioitavaa:
Plasmasytoomien koon muutokset arvioidaan SPD perusteella (sum of the products of the maximal perpendicular diameters) (kohtisuorien maksimaalisten läpimittojen tulojen summa).
Sädehoidettua plasmasytoomaa ei voi käyttää vasteen arvioinnissa (paitsi kasvua voidaan käyttää progressiivisen taudin toteamiseksi).
Kaikki vastearviot (paitsi luuydin ja MRD arvio) edellyttävät kahta perättäistä mittausta ennen kuin vaste on varmistettu (paitsi stabiili tauti). Varmistava tutkimus voidaan tehdä milloin vain (myös samana päivänä).
Mikäli hoidon alussa M-komponentti on jakautunut useammaksi piikiksi, niin niiden summaa käytetään vasteen arvioimiseen.
Erityisesti CR saavuttamisen jälkeen voi immunofiksaatiossa ilmetä eri isotyyppiä oleva M-komponentti (joko raskas- tai kevytketju erilainen kuin alunperin). Tämä todennäköisesti kuvaa oligoklonaalista immuunirekonstituutiota, yleensä häviää ajan myötä, eikä sitä pidä sekoittaa relapsiin.
Muita määritelmiä:
| Refraktaari myelooma |
Tauti on refraktaari jos vähintään minimaalista vastetta (MR) ei saavuteta, tai tauti progredioi (PD) hoidon aikana tai 60 vrk sisällä viimeisestä hoidosta. Refraktaari myelooma sisältää 2 kategoriaa:
|
| Hoitolinjan vaihtuminen | Hoitolinja vaihtuu kun uusia lääkkeitä aloitetaan tai lisätään hoitoon progressiivisen taudin (PD) tai kliinisen relapsin jälkeen (Suomen myeloomaryhmän suositus 15.1.2015). |
Viitteet:
Kumar S. International Myeloma Working Group consensus criteria for response and minimal residual disease assessment in multiple myeloma. Lancet Oncol. 2016 Aug;17(8):e328-46
Hoito
- Kirjaudu tai rekisteröidy kommentoidaksesi
Hoito
Kansalliset hoitosuositukset (FMG)
Kansalliset hoitosuositukset (FMG)
Suomen myeloomaryhmän (FMG) hoitosuositus
Tärkeimmät muutokset vuoden 2021 hoitosuosituksessa (verrattuna edelliseen 2019 hoitosuosituksen):
- Ensilinjan hoito:
- Autologiseen kantasolusiirtoon soveltuvien induktiohoidon vaihtoehdoista VTD poistettu (VCD induktiohoito jätetty).
- Kantasolusiirtoon soveltumattomien hoitovaihtoehdot ennallaan (VRD, LenDex, VMP), mutta niiden väliseen valintaan vaikuttavia seikkoja tarkennettu.
- Uusiutuneen taudin hoito:
- ASCT jälkeen varhaisen relapsin määritelmä 18 kk siirrosta pidennetty (aiemmin 12 kk).
- Poistettu erillinen kappale kantasolusiirtoon soveltumattomien ensimmäisestä relapsista ja yhdistetty se myöhempiin relapseihin.
- Relapsien hoitovaihtoehtoja on huomattavasti päivitetty ja täsmennetty. Vaihtoehdot on jäsennelty uusiksi.
Aiemmat myelooman hoitosuositukset (ei voimassa)
Aiemmat myelooman hoitosuositukset (ei voimassa)
Tälle sivulle on koottu Suomen myeloomaryhmän (FMG) aiempia hoitosuosituksia, jotka eivät ole enää voimassa.
Ensimmäinen yhtenäinen hoitosuositus julkaistiin 2017.
Tärkeimmät muutokset vuoden 2019 hoitosuosituksessa verrattuna edelliseen 2017 hoitosuositukseen:
- Autologisen kantasolusiirron jälkeinen hoito:
- VTD x2 konsolidaatiohoidon tilalle VRD x2 konsolidaatiohoidot.
- Non-HR sytogenetiikka: Lenalidomidi ylläpitohoito progressioon saakka (aiemmin 1 vuosi).
- HR sytogenetiikka: Ylläpitohoitona bortetsomibi + lenalidomidi 1 vuosi, jonka jälkeen lenalidomidi progressioon saakka (aiemmin bortetsomibi 1 vuosi).
- t(14;20) mukaan suuren riskin muutoksiin.
- Kantasolusiirtoon soveltumattomille VMP ja Len/Dex rinnalle VRD hoitovaihtoehdoksi 1. linjassa.
Tukihoidot myeloomassa
Tukihoidot myeloomassa
Bisfosfonaattihoito
Luustolääkitys (bisfosfonaatti tai denosumabi) tulee aloittaa kaikille myeloomapotilaille, joille aloitetaan ensilinjan myeloomahoito, vaikka ei todettaisikaan lyyttisiä luustomuutoksia. Bisfosfonaattihoitoa (BP) ei tule aloittaa rutiinisti potilailla, joilla on oireeton (smoldering) myelooma tai MGUS. BP voidaan käyttää kuitenkin jos smoldering myelooma tai MGUS potilaalla todetaan osteoporoosi, osteoporoosiin käytettävillä annostuksilla. Jos todetaan solitaari plasmasytooma, mutta ei todeta muuten näyttöä myeloomasta, ei ole tarvetta BP hoitoon.
Bisfosfonaateista tsoledronihappo, pamidronaatti ja klodronaatti ovat hyväksyttyjä EU-alueella. Englantilaisessa tutkimuksessa (MRC-IX) tsoledronihapon todettiin lisäävän jonkin verran elinaikaa ja vähentävän luustotapahtumien riskiä enemmän kuin klodronaatin. Pohjoismaisessa tutkimuksessa todettiin pamidronaatin 30 mg olevan yhtä tehokas kuin 90 mg luustotapahtumien ehkäisyssä. Tsoledronihappo infusoidaan 15 minuutissa ja pamidronaatti 2-4 tunnissa. Tsoledronihapon annosta tulee pienentää jos GFR 30-60 ja pamidronaatin infuusioaikaa pidentää > 4h. Pamidronaattia eikä troledronihappoa suositella, jos GFR < 30. Krea/GFR tulee ottaa aina ennen BP infuusiota.
Denosumabilla on myös indikaatio myelooman luustomuutosten ehkäisyssä ja sitä voidaan käyttää bisfosfonaatin sijaan erityisesti jos GFR on alle 30. Denosumabi annostellaan subkutaanisti.
Ei tiedetä hyödyttääkö bisfosfonaatti tai denosumabin potilaita, joilla luustotautia ei ole todettu nykyaikaisilla kuvantamismenetelmillä (TT, MRI). Aiemmat bisfosfonaattien tutkimukset on tehty aikakaudella ennen nykyaikaisia luuston kuvantamismenetelmiä. Denosumabia ja tsoledronaattia vertailevassa tutkimuksessa (Lancet Oncol. 2018) tutkituilla potilailla oli luustotauti.
Suositus luustotaudin hoidosta ja ennettämisestä (hyväksytty Suomen myeloomaryhmän kokouksessa 28.8.2019):
- Jos GFR≥30, niin bisfosfonaattihoito. Ensisijaisesti tsoledronaatti i.v. 4 viikon välein (GFR mukainen annostelu). Toissijaisesti voidaan käyttää pamidronaatti 30 mg i.v. 4 viikon välein.
- Mikäli mahdollinen munuaisten akuutti vajaatoiminta ei korjaannu siten, että bisfosfonaattia voitaisiin käyttää (GFR jää alle 30): Denosumabi 120 mg s.c. 4 viikon välein.
- Hoidon kesto: IV-bisfosfonaattia käytetään 4 viikon välein 1 vuoden ajan (tai 12 infuusion verran mikäli hoidossa taukoja), jonka jälkeen yleensä siirrytään 3 kk välein annosteluun vielä 1 vuoden ajaksi (hoidon kokonaiskesto 2 vuotta). Denosumabi-hoitoa ei harvenneta. Denosumabin hoidon optimaalisesta kestosta ei tietoa.
- Poikkeuksena ne potilaat, joilla ei ole luustotautia: Jos potilaalla ei ole luustotautia ja saavutaan 1 vuoden kohdalla CR tai VGPR, niin luustolääkitys voidaan lopettaa 1 vuoden hoidon jälkeen..
- Relapsissa luustolääkitys aloitetaan yleensä uudelleen (i.v.-bisfosfonaatti voidaan annostella joko kerran kuukaudessa tai 3 kk välein, riippuen aikaisemman hoidon kestosta).
- Kalsium- ja D-vitamiinilisää suositellaan kaikille aloitettavaksi, kun mahdollinen hyperkalsemia on hoidettu.
Leukaluun osteonekroosi
- Kaikille potilaille hammaslääkärin tutkimus, optimaalisen suuhygienian opettaminen, tarvittavat hammastoimenpiteet.
- Jos hoidon aikana tarvitaan kajoavia hammastoimenpiteitä (hampaan poisto, hammasimplantaatti, leukakirurgia), tulee bisfosfonaattihoito tauottaa 90 ennen ja 90 päivää jälkeen toimenpiteen (IMWG suositus).
- Myeloomaryhmä pitää tärkeänä, että luustolääkityksen aloitus ei viivästyisi hammashoidon takia diagnoosivaiheessa mikäli potilaalla on luustotauti. Tarpeettomia invasiivisia hammastoimenpiteitä tulee välttää ja hammashoito tulisi toteuttaa konservatiivisesti, mikäli mahdollista. Invasiivisen hammastoimenpiteen tarpeellisuus ja ajoitus tulee arvioida hammaslääkärin ja myeloomaa hoitavan lääkärin yhteistyönä. Mikäli aivan akuuttia tarvetta invasiiviselle hammastoimenpiteelle ei ole, niin mahdollinen toimenpide kannattaa lykätä tehtäväksi myöhemmin myeloomatilanteen rauhoituttua. Jos hampaan poisto tarvitsee tehdä pian diagnoosin jälkeen, niin yleensä luustolääkitys kannattaa aloittaa heti kun hampaanpoistoalue on kliinisesti parantunut (esim. 1 kk hampaanpoistosta) eikä odottaa em. 90 päivää.
- Bisfosfonaattia ei tarvitse tauottaa rutiinitoimenpiteitä varten mm. ennen hampaan paikkausta, juurihoitoa tai hammaskiven poistoa.
- Jos todetaan leuan osteonekroosi, tulee bisfosfonaattihoito keskeyttää. Uudelleen aloituksessa tulee punnita yksilökohtaiset hyödyt ja haitat erityisesti myelooman relapsissa tai refraktaarissa taudissa.
Viitteet:
Terpos E. International Myeloma Working Group Recommendations for the Treatment of Multiple Myeloma–Related Bone Disease. Journal of Clinical Oncology 2013;31(18):2347-57 (linkki).
Hyperkalsemian hoito
Hyperkalsemia (Akuuttihoito-opas).
Hyperkalsemia on yleensä merkkinä myelooman aktivoitumisesta. Hyperkalseemisesta kriisistä puhutaan, jos P-Ca on yli 3,75 mmol/l ja P-Ca-Ion on yli 2,0 mmol/l.
Hyperkalsemian hoito
- dehydraation korjaaminen ja diureesin varmistaminen
- nesteytys toteutetaan fysiologisella keittosuolalla
- huolehdi kalium- ja magnesiumtasapainosta
- kalsiumeritystä voidaan tehostaa furosemidilla
- glukokortikoidit; prednisolon tai metyyliprednisolon 30 – 100 mg päivässä
- tsoledronihappo (varovaisuutta munuisten vajaatoiminnassa) tai denosumabi
- kalsitoniini, vaikutus alkaa nopeasti, on lyhytaikainen, soveltuu myös munuaisten vajaatoimintapotilaille
- myelooman spesifinen hoito liitetään mukaan heti, kun se on mahdollista
Kirurginen hoito
Neurokirurginen hoito
- Mikäli myeloomapotilaalla on akuutti parapareesi selkäydinkompressiosta johtuen, konsultoi päivystävää neurokirurgia mahdollisesta leikkauksesta. Dexametasoni 40 mg/ vrk aloitetaan samanaikaisesti.
Vertebroplastia ja kyfoplastia
- Jos nikamaluhistuman aiheuttama selkäkipu ei hellitä konservatiivisin keinoin voidaan selvittää mahdollisuudet vertebroplastiaan tai kyfoplastiaan. Molemmissa tekniikoissa perkutaanisesti injektioidaan luusementtiä nikamaan. Ne ovat tehokkaampia kun ne tehdään lyhyen ajan sisällä nikamaluhistumasta. Molempiin tekniikkoihin liittyy pieni riski sementin vuotamisesta johtaen keuhkoveritulppaan tai neurokompressioon.
Kyriakou et al. The role of cement augmentation with percutaneous vertebroplasty and balloon kyphoplasty for the treatment of vertebral compression fractures in multiple myeloma: a consensus statement from the International Myeloma Working Group (IMWG). Blood Cancer J. 2019 Feb 26;9(3):27
Tromboosiprofylaksia
Myeloomaan liittyy itsellinen laskimotukosriski. Sitä lisäävät vielä infektiot, venakatetrit, obesiteetti, munuaisten vajaatoiminta, ikä.
Immunomodulaattori (IMiD; talidomidi, lenalidomidi, pomalidomidi) hoitoon on liitettävä tromboosiprofylaksia. IMiD monoterapiassa riski on pienempi, mutta yhdistelmähoidossa (deksametasoni, solunsalpaajat) riski nousee noin 10%:iin. Mikäli potilaalla on vain 0-1 riskitekijää, riittää ASA-profylaksia (70-100 mg/vrk). Jos riskitekijöitä on 2 tai useampi tulisi käyttää pienimolekylaarista hepariinia (LMWH) tai varfariinia. Jos varfariini on käytössä muista syistä voidaan sitä jatkaa, mutta LMWH on syöpäpotilaille useimmiten suositeltavampi. Tukosprofylaksiaa tulisi käyttää ainakin ensimmäiset 4-6 kuukautta (tukosriskin ollessa suurin hoidon alussa), jonka jälkeen sen keventämistä voi harkita (esim. siirtyminen LMWH:sta ASA-profylaksiin). Jos tromboosi syntyy, sen hoidossa noudatetaan tavanomaisia hoitokäytäntöjä. Kun tilanne on stabiloitunut immunomodulaattorihoitoa ei yleensä pidetä vasta-aiheisena kunhan antikoagulanttihoito on adekvaatti.
Palumbo A et al. Prevention of thalidomide- and lenalidomide-associated thrombosis in myeloma. Leukemia 2008:22:414 – 423.
Snowden JA, et al. Guidelines for supportive care in multiple myeloma 2011. BJH 2011:154:76-103
Anemian hoito / Erytropoietiinihoito
Hoidon aiheena on oireinen anemia, yleensä Hb < 100g/l. Vaihtoehtoina eri epoetiinit (alfa, beeta, zeta), jolloin aloitusannos on 30 000- 40 000 KY kerran viikossa sc tai pitkävaikutteinen darbepoetiini 6.25µg/kg 3 vk välein. Jos Hb nousee > 120g/l, EPO-hoito pitää lopettaa/tauottaa.
Sädehoito
Selkäydinkompressiossa on sädehoito aloitettava nopeasti (< 2 vrk), ja hoitoon liitetään korkea-annosdeksametasoni.
Paikallinen sädehoito on usein tehokasta kivunhoitoa kivuliaissa luustopesäkkeissä, annoksena suositellaan 8 Gy kertafraktiona.
Lisäksi sädehoidon indikaationa on plasmasytoomien aiheuttamat kompressio-oireet. Laajoja sädehoitoja luuydinalueille pyritään välttämään ennen kantasolujenkeruuta, jos kliinisesti mahdollista. Hb-tason on oltava sädehoidon aikana > 100 g/l.
Infektiot
- Suositellaan rokotusta influenssaa, Streptococcus pneumoniae (konjugaattirokote) ja Haemophilus influenzae vastaan kaikille, vaikkakin niiden tehokkuus on epävarmaa. Myös perheenjäsenten rokottaminen influenssaa vastaan on suositeltavaa.
- Profylaktista IV-immunoglobuliinihoitoa ei rutiinisti suositella, mutta se saattaa olla hyödyllistä pienellä alaryhmällä potilaita, joilla vaikeita toistuvia bakteeri-infektioita ja hypogammaglobulinemia.
- Profylaktista VZV-profylaksiaa (asikloviiri 400 mg x1) on käytettävä proteasomi-inhibiittori (mm. bortetsomibi) hoitoa saavilla potilailla.
- Kansainvälisissä suosituksissa ei ole otettu kantaa pneumocystis jirovecii estolääkityksen tarpeellisuuteen. Useimmissa kliinisissä myeloomatutkimuksissa pneumocystis estolääkitystä ei ole edellytetty. Suositellaan toimimaan oman keskuksen käytännön mukaisesti.
Palliatiivinen hoito
Tarkoituksena on kivun, taudin aiheuttamien oireiden ja kärsimysten lievittäminen. Tässä vaiheessa ei ole enää tärkeää saada kontrolloitua tautivastetta, vaan potilaan oireita.
Kivun lievitykseen käytetään syöpäpotilaan kipulääkkeitä, ja paikallisia kipusädehoitoja. Vaikeissa tilanteissa on syytä tehdä kipupoliklinikan konsultaatio. Ummetusta ehkäisevä lääkitys, sopiva nesteytys, ja suun kuivamisoireiden hoito on tärkeää. Psyykkisestä tuesta huolehditaan, ja terminaalivaiheen lähestyessä potilaan omat toiveet käydään läpi.
Tukosriskin arviointi immunomoduloivan (IMiD) hoidon yhteydessä
- Kirjaudu tai rekisteröidy kommentoidaksesi
Tukosriskin arviointi immunomoduloivan (IMiD) hoidon yhteydessä
Potilasperäiset ja myeloomasta johtuvat riskitekijät:
- Tuore myelooma
- Hyperviskositeetti
- Aiemmin sairastettu syvälaskimotukos tai suvussa esiintyvä laskimotukosalttius
- Ylipaino (BMI ≥30)
- Komorbiditeetit: sydän, diabetes, munuaisten vajaatoiminta, krooninen tulehduksellinen sairaus
- Immobiliteetti (akuutti tai krooninen)
- Trombofilia, myeloproliferatiivinen tauti, hemoglobinopatia
- Hiljattainen kirurgia (6 viikon sisällä)
- Lääkitykset: erytropoieesia stimuloivat lääkkeet (ESA), hormonikorvaushoito, tamoksifeeni
Jos 0-1 riskitekijää (eikä mitään alla mainituista myeloomaan hoitoon liittyvistä riskitekijöistä): harkitse ASA (70-100 mg päivässä).
Jos 2 tai enemmän riskitekijää: LWMH tai varfariini.
Myelooman hoitoon liittyvät riskitekijät:
- Doksorubisiini
- Suuri-annoksinen steroidi (≥480 mg/kk deksametasonia tai vastaava)
- Kombinaatiokemoterapia
Jos jokin yllä mainituista myelooman hoitoon liittyvistä riskitekijöistä, niin LMWH tai varfariini.
Myelooman hoito yli 70-75 vuotiailla
Myelooman hoito yli 70-75 vuotiailla
Iäkkäiden hoitokuntoisuuden arviointiin ja tutkimusten yhtenäistämiseksi on kehitetty geriatrinen arviointimittari (Myeloma Frailty Score Calculator) (linkki). Sen käyttö tutkimusten ulkopuolella on kuitenkin työlästä. Käytännönläheisempi lähestymistapa on pitää heikkokuntoisena (frail) henkilöä, joka tarvitsee apua kodinhoidossa tai itsestään huolehtimisessa.
Yli 75 vuotiaille, heikkokuntoisille sekä niille joilla on merkittäviä perussairauksia, suositellaan lääkehoitoa annosvähennyksin.
Ks. Suomen myeloomaryhmän (FMG) kansallinen hoitosuositus (alkaen sivu 7): kohta "transplant-ineligible - ensilinjan hoito".
Myeloomahoitojen annosreduktiot
- Kirjaudu tai rekisteröidy kommentoidaksesi
Myeloomahoitojen annosreduktiot
Riskitekijät :
1. Ikä yli 75 v
2. Heikkokuntoisuus (frailty):
- Avuntarve kodinhoidossa tai itsestään huolehtimisessa (pukeutuminen, peseytyminen, WC-käynti, ruokailu)
3. Komorbiditeetit:
- Sydämen toimintahäiriö
- Keuhkojen toimintahäiriö
- Maksan toimintahäiriö
- Munuaisten toimintahäiriö
0 riskitekijää : käytä annostasoa 0 ("Go-Go")
1 riskitekijä : käytä annostasoa -1 ("Moderate-Go")
1 riskitekijä + gradus 3-4 non-hematologinen haittavaikutus (AE) : käytä annostasoa -2 ("Slow-Go")
Viitteet:
Palumbo A, Anderson K. Multiple myeloma. N Engl J Med 2011;364(11):1046-1060.
Palumbo A, Bringen S, Ludwig H, et al. Personalized therapy in multiple myeloma according to patient age and vulnerability: a report of the European Myeloma Network (EMN). Blood 2011; 118(17): 4519-29
Zweegman S, Engelhardt M, Larocca A; EHA SWG on ‘Aging and Hematology’. Elderly patients with multiple myeloma: towards a frailty approach? Curr Opin Oncol. 2017 Sep;29(5):315-321. (referoitu myös: Multiple myeloma: EHA-ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up 2021, Suppl)
|
Lääke |
Annostaso 0 |
Annostaso -1 |
Annostaso -2 |
|
Bortetsomibi |
1,3 mg/m2 SC D1, 4, 8, 11 3 vkon sykli |
1,3 mg/m2 SC D1, 8, 15, 22 5 viikon sykli |
1,0 mg/m2 SC D1, 8, 15, 22 5 viikon sykli |
| Karfiltsomibi |
(KRD yhdistelmässä) 20 mg/m2 D1-2, 8-9, 15-16 syklissä 1, 27 mg/m2 syklistä 2 |
(KRD yhdistelmässä) 20 mg/m2 sykli 1 → 27 mg/m2 sykli 2, päivinä 1, 8, 15 |
(KRD yhdistelmässä) 20 mg/m2 päivinä 1, 8, 15 |
| Iksatsomibi |
4 mg PO D1, 8, 15 4 viikon sykli |
3 mg PO D1, 8, 15 4 viikon sykli |
2,3 mg PO D1, 8, 15 4 viikon sykli |
|
Talidomidi |
100 mg/pv PO |
50 mg/pv PO |
50 mg j.t.p PO |
|
Lenalidomidi |
25 mg/pv PO D1-21 4 viikon sykli |
15 mg/pv PO D1-21 4 viikon sykli |
10 mg/pv PO D1-21 4 viikon sykli |
| Pomalidomidi |
4 mg PO D1-21 4 viikon sykli |
3 mg PO D1-21 4 viikon sykli |
2 mg D1-21 4 viikon sykli |
|
Deksametasoni |
40 mg/pv PO D1, 8, 15, 22 4 viikon sykli |
20 mg/pv PO D1, 8, 15, 22 4 viikon sykli |
10 mg/pv PO D1, 8, 15, 22 4 viikon sykli |
|
Melfalaani |
0,25 mg/kg PO (9 mg/m2) D1-4 / 4-6 viikkoa |
0,18 mg/kg PO (7,5 mg/m2) D1-4 / 4-6 viikkoa |
0,13 mg/kg PO (5 mg/m2) D1-4, 4-6 viikkoa |
|
Prednisoni |
60 mg/m2 PO D1-4 TAI 50 mg j.t.p PO |
30 mg/m2 PO D1-4 TAI 25 mg PO j.t.p. |
15 mg/m2 PO D1-4 TAI 12,5 mg PO j.t.p. |
|
Syklofosfamidi |
300 mg/m2 PO D1, 8, 15, 22 TAI 100 mg/pv PO D1-21 4 viikon sykli |
150 mg/m2 PO D1, 8, 15 TAI 50 mg/pv PO D1-21 4 viikon sykli |
75 mg/m2 PO D 1, 8, 15 TAI 50 mg j.t.p. PO D1-21 4 viikon sykli |
Sädehoito
Sädehoito
Selkäydinkompressiossa on sädehoito aloitettava nopeasti (< 2 vrk), ja hoitoon liitetään korkea-annosdeksametasoni.
Muita sädehoidon indikaatioita ovat kivuliaat luustopesäkkeet, patologiset murtumat ja kompressio-oireita aiheuttavat plasmasytoomat.
Laajoja sädehoitoja luuydinalueille pyritään välttämään ennen kantasolujenkeruuta, jos kliinisesti mahdollista.
Hb-tason on oltava sädehoidon aikana > 100 g/l
Kantasolujensiirto
Kantasolujensiirto
Autologisen kantasolujensiirron aiheet
- Toistaiseksi autologinen kantasolujensiirto on standardihoito ensilinjan hoitona <66 (-70v) vuotiailla potilailla, jotka ovat saaneet hyvän vasteen (VGPR- hyvä PR vähintään) induktiohoidolle. Yleinen suositus on 3 - 4 induktiohoitoa ennen kantasolujenkeräystä. Induktiovaiheessa toksisuus kuitenkin lisääntyy, mitä enemmän hoitolinjoja käydään läpi vasteeseen pyrkiessä.
Allogeenisen kantasolujensiirron aiheet
Primaarivaihe
Konsultoidaan allogeenista siirtokeskusta, jos nuori – keski-ikäinen potilas ja
• ei allogeenista siirtoa estäviä muita sairauksia
• suuren riskin taudin piirteitä: suuri tuumoritaakka, aggressiivinen taudinkuva,
• plasmasoluleukemia, ekstramedullaarinen tauti,
• sytogenetiikka: 17p del ja /tai t(4;14), t(14;16), ja erityisesti jos vielä ISS 3
Relapsi/progressiovaihe:
Yleensä sytogenetiikka tutkitaan uudelleen, ja jos on tullut suuren riskin löydöksiä, relapsi käyttäytyy aggressiivisesti ja potilas on allosiirtokuntoinen. Jos relapsi tulee nopeasti, konsultoidaan siirtokeskusta herkästi lievemmissäkin tapauksissa. Allogeeninen siirto ei ole enää järkevä hoito-optio, kun potilaalla on ollut jo useita taudin uusiutumisia.
Autologisen kantasolusiirron toteutus
Autologisen kantasolusiirron toteutus
Autologisen kantasolusiirteen keräys
Autologiset kantasolut kerätään induktiohoidon jälkeen. Induktiohoito tauotetaan 2 – 4 vk ennen kantasolujen keräystä.
Standardi mobilisaatiohoito on syklofosfamidi 2 g/m2 + filgrastiimi 5 – 10 µg/kg/pv tai pegyloitu filgrastiimi 6 – 12 mg. Jos saalis on riittämätön, mikä on harvinaista (paitsi, jos taustalla on laaja sädehoito + talidomidi + runsaasti muita hoitoja), suositellaan uutta keräysyritystä yhdistelmällä: filgrastiimi +/- plerixafor.
Keräyssaaliin minimitavoite on 2 x 10E6 CD34+ solua/kg yhteen siirtoon, mutta suositeltava saalistavoite on 4 x 10E6 solua/kg /siirto. Mikäli mahdollista, pyritään keräämään 8 – 10 x 106 solua/kg, mikä mahdollistaa kaksi täysimittaista autologista intensiivihoitoa (IMWG - konsensus). Toisen intensiivihoidon asema ei ole enää yhtä selvä kuin oli ennen myelooman uusien lääkkeiden (ns.”novel agents”) aikakautta.
Tavoitteena on saavuttaa hoidoin vähintään PR - vaste ennen kantasolujen mobilisaatiota. Joskus voidaan harkinnan mukaan tyytyä siihen, että on saavutettu vain stabiili tautivaste. Tarvittaessa hoitovastetta voidaan pyrkiä syventämään ennen intensiivihoitoa jatkamalla talidomidi + deksametasonihoitoa pitempään. Jos vaste tälle hoidolle jää puutteelliseksi, toisen linjan hoitona käytetään useimmiten bortetsomibi + deksametasonihoitoa (korkea-annosdeksametasoni). Jos tauti progredioi talidomidi + deksametasonihoidon aikana, voidaan harkita siirtymistä suoraan kolmen lääkkeen yhdistelmähoitoon, kuten esim. PAD - tai CVD - hoitoon. Kolmannen linjan hoitona voi tarvittaessa käyttää lenalidomidi + dexametasonihoitoa (matala-annosdeksametasoni, 40 mg x 1 /vk + tromboosiprofylaksia). Jos myelooma on primaaristi refraktääri, käytetään 3. - 4. linjan hoitovaihtoehtoja: VDT-PACE, RVD, RCD, DT-PACE, DCEP, HyperCVAD.
Autologinen intensiivihoito ja kantasolujen palautus
Esihoitona melfalaani 200 mg/m2 (hemodialyysipotilaat/munuaisfunktio alentunut: maksimiannos 140 mg/m2)
Filgrastiimi- tuki siirron jälkeen harkinnan mukaan.
Siirteen tarttumisen päivä = kun B-neutrofiilit > 0,5 x 109/l, kirjataan.
Siirteen tarttumisen varmistaminen: neutrofiilien pysyttävä em. tasolla kolme vrk.
Paras hoitovaste arvioidaan 3 kk kohdalla siirrosta.
Jos 1. siirron vaste on huonompi kuin VGPR, voidaan harkita tehtäväksi tandem-siirto 4 – 6 kk kuluttua 1. siirrosta.
Intensiivihoidolla saavutetussa VGPR/CR – tilanteessa ei käytetä ylläpitohoitoa. PR - tilanteessa voi harkita konsolidaatiohoitoa/lisähoitoja hoitovasteen syventämiseksi. Rutiininomaisen konsolidaatiohoidon puolesta ei ole kuitenkaan vielä riittävää näyttöä. Mikäli kyseessä on huonon ennusteen tauti, eikä allogeenisen siirron mahdollisuutta ole, konsolidaatio – ja ylläpitohoitoa on harkittava (bortetsomibi, lenalidomidi).
Rokotussuoja rakennetaan uudelleen 6 kk kuluttua siirrosta, alueellisten käytäntöjen mukaan.
Autologisen intensiivihoidon jälkeinen seuranta
VGPR/CR - vasteen saavuttaneet
Seuranta ja laboratoriokokeet (PVK, krea, ionisoitunut Ca, AFOS, CRP, LD, S- ja dU-proteiinifraktiot) 2 – 4 kk välein, harventaen edelleen, jos hyvä vaste säilyy. CR- vasteen varmistaminen edellyttää vähintään kerran vuodessa tapahtuvaa S- ja dU- immunofiksaatioiden tarkistamista S- ja dU- proteiinifraktiointien lisäksi, sekä luuydinnäytteen tutkimista. Non-sekretoorisessa myeloomassa tutkitaan em. lisäksi S-vapaat kevytketjut. Stringent CR – vasteen varmistamisessa käytetään edellä mainittujen lisäksi virtaussytometristä jäännöstautimääritystä.
PR – vasteen saavuttaneet
Joissakin tapauksissa, kuten PR – vasteessa, totaali-immunoglobuliinitason (S- IgG, S-IgA) seuraaminen voi riittää. Se ei kuitenkaan kerro tarkkaa paraproteiinin määrää, ja progressio-epäilyssä ja/tai vasteen parantuessa on tarkistettava S- ja dU- proteiinifraktioinnit ja – immunofiksaatiot.
Aiemmat FMG tutkimukset
Aiemmat FMG tutkimukset
Suomen myeloomaryhmän (FMG) aiemmista kliinisistä tutkimuksista löydät tietoa täältä. Kyseiset tutkimukset eivät enää rekrytoi.
Information on former clinical studies organized by the Finnish Myeloma Group can be found here
FMGMM01 (Veldex)
FMGMM01 (Veldex)
VelDex tutkimuksen aktiivivaihe on päättynyt, ja artikkeli julkaistu BJH Feb 2013. Kiitos kaikille tutkimukseen osallistuneille yhteistyöstä! Molekulaarisessa remissiossa olevilta pyydän vielä ottamaan toistaiseksi PCR-seurantanäytteitä, koska apurahaa on jäljellä. Muiden potilaiden PFS/OS aikaa seurataan.
Tutkimuksen arvioitu seurantavaiheen päättymisaika on 31.12.2014.
Kliiniset tutkimukset (myelooma)
Kliiniset tutkimukset (myelooma)
Tietoa kliinisistä myeloomatutkimuksista Suomessa.
Helsingin ja Uudenmaan sairaanhoitopiirissä (HUS) menossa olevat kliiniset tutkimukset löytyvät HUS:n kotisivuilta (linkki).
TYKS-Erva alueen tutkimukset löytyvät Läntisen Syöpäkeskuksen kotisivuilta (linkki).
TAYS Syöpäkeskuksen tutkimukset löytyvät TAYS:n kotisivuilta (linkki).
OYS ja Pohjois-Pohjanmaan sairaanhoitopiirin (PPSHP) tutkimukset löytyvät Pohjoisen Syöpäkeskuksen kotivuilta (linkki).
Pohjoismainen myeloomaryhmän (NMSG) tutkimukset löytyvät NMSG:n kotisivuilta (linkki).
Seuraavat tutkimukset eivät enää rekrytoi uusia potilaita:
- NMSG#23/15. Faasin 2 tutkimus iksatsomibi + lenalidomidi + deksametasonin (IRd) vaikutuksesta jäännöstautiin tuoreessa myeloomassa kantasolusiirtoon soveltuvilla (yhteenvetoon linkki). Rekrytointi päättynyt 3/2020.
- NMSG#20/13. Faasin 2 tutkimus karfiltsomibin käytöstä induktio-, korkea-annos- ja ylläpitohoidossa järjestyksessään toisen autologisen kantasolusiirron yhteydessä potilailla, joiden tauti etenee ensimmäisen siirron jälkeen (linkki). Rekrytointi päättynyt 4/2018.
- NMSG#24/15. Faasin 2 tutkimus karfiltsomibin + elotuzumabin + deksametasonin käytöstä 1-3 aiemman hoitolinjan jälkeen uusiutuneen tai etenevän myelooman hoidossa (protokollaan linkki). Rekrytointi päättynyt 2/2019.
FMGMM02
- Kirjaudu tai rekisteröidy kommentoidaksesi
FMGMM02
Uusien potilaiden rekrytointi päättynyt.
FMGMM02-tutkimuksen protokolla ja 1. amendmentti on ladattavissa alla olevista liitteistä.
The final version and the 1st amendment to the FMGMM002 study protocol can be downloaded from the links at the bottom of the page.
Potilasohje
- Kirjaudu tai rekisteröidy kommentoidaksesi