MDS
MDS
Myelodysplastiset oireyhtymät:
- klonaalisia hematopoieettisen kantasolun sairauksia, joissa keskeisenä piirteenä on luuytimen tehoton verisolujen muodostus, joka ilmenee verenkuvassa matalina soluarvoina ja luuytimen morfologiassa solujen erilaistumisen ja kypsymisen häiriintymisenä (dysplasioina)
- yleisin pahanlaatuinen verisairaus yli 70-vuotiaiden ikäryhmässä, jossa sen vuosittainen ilmaantuvuus ylittää 20 / 100 000
- diagnoosi perustuu verenkuvaan, luuytimen morfologiaan, histologiaan ja kromosomitutkimukseen; täydentävänä tutkimuksena virtaussytometria, lähitulevaisuudessa todennäköisesti myös molekyyligenetiikka
- matalan riskin taudissa hoidon tavoitteena on korjata anemiasta johtuvia oireita ja parantaa elämänlaatua
- korkean riskin taudissa ennuste on huono (noin yksi vuosi), ja hoidon tavoitteena on estää leukemisoitumista ja pidentää elinikää
- ainoa potentiaalisesti parantava hoito on allogeeninen kantasolujensiirto
- muita hoitoja ovat hematopoieettiset kasvutekijät, immunomoduloivat lääkkeet (lenalidomidi), immunosuppressiiviset lääkkeet (ATG, siklosporiini), hypometyloivat lääkkeet (atsasitidiini), solunsalpaajat ja oireenmukaiset tukihoidot
Käynnissä olevat tutkimukset:
Celgene: A phase 3, multicenter, randomized, double-blind study to compare the efficacy and safety of oral azacitidine plus best supportive care versus placebo plus best supportive care in subjects with red blood cell transfusion-dependent anemia and thrombocytopenia due to IPSS lower-risk myelodysplastic syndromes. Yhteyshenkilö: Freja Ebeling/HUS. Tutkimuksen potilasrekrytointi päättynyt kesällä 2018.
HUS yhteistyössä pohjoismaisen MDS-ryhmän kanssa: Uusien molekyylilääketieteen menetelmien käyttö myelodysplastisen syndrooman diagnostiikassa ja hoitovasteen seurannassa (MDS-MOLE-2015). yhteyshenkilöt: Freja Ebeling, Johanna Illman/HUS
| Kirjoittajat: | Freja Ebeling, Johanna Gustafsson, Annasofia Holopainen, Johanna Illman, Elina Itkonen, Maija Itälä-Remes, Marjut Kauppila, Mikko Keränen, Sirpa Koskela, Outi Laine, Sini Luoma, Eeva Martelin, Mikko Myllymäki, Minna Nyypyy, Tarja-Terttu Pelliniemi, Eira Poikonen, Anu Partanen, Marja Sankelo, Sanna Siitonen, Timo Siitonen, Anri Tienhaara, Sanna Vormisto |
| Viimeisin päivitys: | 17.02.2017 |
| © Suomen Hematologiyhdistys | Suomen Leukemiaryhmä |
Diagnoosi
Diagnoosi
Diagnoosivaiheen tutkimukset
Anamneesi
- aikaisemmat solunsalpaaja- ja sädehoidot, liuotinaltistukset
- käytössä olevat lääkkeet ja luontaistuotteet, tupakointi, alkoholinkäyttö
- vuoto- ja infektiotaipumus
- mahdolliset sukulaisten verisairaudet
- sukulaisten muut merkittävät sairaudet ja poikkeava syöpien esiintyminen (periytyviä luuytimen toimintahäiriöitäkin ajatellen, mm. Fanconin anemia ja telomeropatiat)
- vanhempien (ja isovanhempien) kuoliniät ja -syyt
- hoitovalintoihin vaikuttavat perussairaudet (komorbiditeetti)
- 70-vuotiailta ja nuoremmilta täyssisarusten olemassaolo, ikä ja yleinen terveydentila
Status
- pernan koko
Veri- ja virtsanäytteet
Perusnäytteet
- B-La, P/S-CRP, B-PVK+T+valkosolujen erittelyjakauma, B/E-Retik, P-Haptog, E-Coomb-0, fP-Trfesat (fP-Fe ja fP-Transf), P/S-TfR, P-Ferrit, biologisesti aktiivinen B12-vitamiini, fE-Folaat, P-Krea, P-ALAT, P-AFOS, P-Bil, P-Bil-kj, P-LD, P/S-Alb, S-Prot-Fr, P/S-Uraat, S-B2Miglo, P/S-TSH, S-HIVAgAb, S-HBsAg, S-HBcAb. S-HCVAb, S-ParvAb, U-Perustutkimus (PLV).
Erikoisnäytteet
- S-EPO, jos harkitaan kasvutekijähoitoa (erytropoietiini +- G-CSF)
- leukosyyttien PNH-koe, jos luuydin on hypoplastinen, harkitaan immunosuppressiivista hoitoa tai PNH on erotusdiagnostinen mahdollisuus
- HLADR15, jos harkitaan immunosuppressiivista hoitoa
- plasman lyijypitoisuus harkinnan mukaan
- B-Hb-Fr harkinnan mukaan
- nuorehkoilla potilailla, etenkin familiaarisen sytopenian yhteydessä, harkitaan Fanconin anemian mahdollisuuden selvittämistä (Fanconin anemian geenipaneelitutkimus)
- nuorehkoilla potilailla (ja etenkin, jos keuhkofibroosia tai dyskeratosis congenita -piirteitä): telomeeripituus ja -mutaatiotutkimukset: 1) Uumaja: Kliniskt Genetiskt Laboratorium, 5-10 ml EDTA-verta + lähetelomake, ensin TERT+TERC -mutaatioanalyysi (8000 Skr), jos neg, DKC1- ja TINF2-mutaatioanalyysi (7000 SKr), harkinnan mukaan telomeeripituus (3000 SKr), anna.norberg@vll.se, 2) Bern: Experimental Hematology, 7-15 ml EDTA-verta + lähetelomake, ensin telomeeripituusanalyysi (1708 SFr eli n. 1632 €) ja jos lyhentymää, mutaatioseulonta portaittain (500-5000 SFr), monika.haubitz@insel.ch, (Kansallinen/yhteispohjoismainen BMF-mutaatioseulontapaneeli on pohdittavana, ei vielä rutiinikäytössä, HUS:n HEMAHARV-pkl/Ulla Wartiovaara-Kautto konsultoitavissa.)
- aplastisen anemian kaltaisen taudinkuvan yhteydessä GATA2-vajausta epäiltäessä mutaatioseulonta: Newcastle, Haematological Sciences, Institute of Cellular Medicine, venetia.bigley@ncl.ac.uk (HUS:n HEMAHARV-pkl konsultoitavissa, kts. ed.)
- hyväkuntoisilta alle 70-vuotiailta HLA-1-tyypitysnäyte (Ly-HLA I), jos harkitaan allogeenisen kantasolusiirtohoidon mahdollisuutta
Luuydinnäyte
- ensisijaiset tutkimukset
- pelkkää anemiaa selviteltäessä alkuun vain perifeerisen veren sivelyvalmisteen ja luuydinaspiraatin morfologinen tutkimus rautavärjäyksineen - seulonta
- MDS-epäilystä syytä mainita morfologialähetteessä, jolloin toivotaan myös <5% blastiosuuden tarkempaa määritystä (koska IPSS-R-luokituksessa yhtenä kriteerinä blastiosuus 0-2% tai > 2%)
- jos luuydinmorfologiassa on dysplasiaviitteitä tai jos anemian lisäksi on trombosytopeniaa, neutropeniaa tai perifeerisessä veressä neutrofiilidysplasiaa, tutkitaan aspiraationäytteestä myös karyotyyppi (luuytimen hematologinen kromosomitutkimus) ja jos G-raitatutkimus ei onnistu, suositellaan harkittavaksi kohdennettua interfaasi-FISH-tutkimusta
- luuydinbiopsia (Bm-PAD) solukkuuden, blastiosuuden ja fibroosiasteen tutkimiseksi
- lisätutkimukset
- luuytimen solujen virtaussytometrisessa immunofenotyypityksessä voidaan todeta dysplastinen kypsymisprofiili neutrofiilisarjassa, monosyyteissä tai erytroblasteissa sekä arvioida blastien osuutta ja niiden mahdollisia poikkeavia antigeeni-ilmentymiä sekä laskea ns. Ogata score. Virtaussytometrisesta immunofenotyypityksestä voidaan saada lisätukea MDS:n diagnoosille ja ennusteen arvioimiselle, ja sitä voidaan käyttää apuna hoitovasteen seurannassa. Virtaussytometrinen immunofenotyypitys tehdään harkinnan mukaan, ja eri keskuksissa on erilaiset käytännöt.
- MDS:ssä kuvattujen mutaatioiden seulonta syväsekvensointimenetelmillä (NGS) on tulossa olennaiseksi osaksi MDS-diagnostiikkaa ja ennustearviointia, mutta ei vielä ole kaikkialla rutiinikäytössä eikä toistaiseksi vaadittavissa diagnostiikkaan. Noin 90%:lla MDS-potilaista on kuvattu löytyvän tautimutaatioita, joita on kuvattu >40 myelooisessa geenissä. Yleisimmät mutatoituneet geenit ovat TET2, SF3B1, ASXL1, DNMT3, SRSF2, RUNX1, U2AF1, EZH2 ja TP53. Mutaatiotiedon soveltaminen kliinisiin ratkaisuihin on nopeassa kehitysvaiheessa.
Erotusdiagnostiikassa huomioitavaa
- B12-vitamiinin tai folaatin puute
- kroonisen sairauden anemia
- autoimmuunisytopeniat
- krooninen maksasairaus ja/tai runsas alkoholinkäyttö
- krooniset virusinfektiot (HIV/HBV/HCV/Parvo/CMV/EBV)
- raskasmetallialtistukset
- lääkeaineiden tai muiden toksisten aineiden aiheuttamat sytopeniat
- aplastinen anemia
- PNH
- myelofibroosi
- muut kantasolusairaudet (mm. akuutit leukemiat)
- Fanconin anemia
- LGL-leukemia, karvasoluleukemia
- geneettiset ei-malignit tilat, kuten kongenitaalinen sideroblastianemia
Luokitus
Luokitus
- FAB-luokitus, jossa myelodysplastinen oireyhtymä (MDS) jaettiin viiteen alaryhmään blastiosuuden, luuytimen rengassideroblastien ja veren monosyyttimäärän perusteella, oli käytössä vuodesta 1982.
- WHO 2008 -luokitus, joka on esitetty alla olevassa taulukossa.
- WHO 2008 -luokitukseen 2016 tehdyt revisiot, joista lisätty lyhyet maininnat kursiivilla punaisella fontilla allaolevaan taulukkoon.
- FAB-luokitukseen perustuva MDS-riskiluokitus, IPSS-ennusteluokitus (International Prognostic Scoring System) julkaistiin 1997 (taulukossa, joka löytyy seuraavalta sivulta, myös keskimääräisiä elinaikatietoja).
- Uusi, 2012 julkaistu IPSS-R-luokitus jakaa MDS-potilaat viiteen ennusteeltaan eroavaan ryhmään ja on tulossa yleiseen käyttöön. Siinä erotellaan sytopenioiden syvyys aiempaa tarkemmin samoin kuin luuytimen blastiosuus (0-2% ja >2-5%), ja sytogenetiikan perusteella erotellaan aiemman kolmen asemasta viisi riskiryhmää. (IPSS-R-riskipistelaskuri: http://ipss-r.com/)
-
WHO-luokitukseen pohjautuva WPSS-ennusteluokitus julkaistiin 2007 ja soveltuu käytettäväksi myös diagnoosivaiheen jälkeen.
- Uusia, vielä arvioitavana olevia mahdollisia ennustetekijöitä ovat ferritiinitaso, transfuusiotiheys, luuytimen fibroosi, LD-taso, beeta-2-mikroglobuliinitaso ja CD34-soluklusterit luuytimessä.
- ei-hematologisten oheissairauksien huomioimiseen riskiarviossa on kehitetty MDS-specific comorbidity index (MDS-CI) (Della Porta et al. 2011)
Taulukko. WHO 2008 -luokitus, johon lisätty myös ICD-0-koodit, punaisella 2016 revisiot
|
Alaluokka |
Myeloblastit veressä (%) |
Muu |
Myeloblastit ytimessä (%) |
Luuytimen löydökset |
|
RCUD 2016: MDS-SLD ilman erittelyä |
<11 |
yhden, joskus kahden linjan sytopenia |
< 5 |
>10 % yhden linjan soluista dysplastisia <15% erytroblasteista rengassideroblasteja |
|
RARS 2016: MDS-RS-SLD
|
0 |
anemia |
< 5 |
>15% erytroblasteista rengassideroblasteja, 2016: >=5 % jos SF3B1 -mutaatio vain erytroisen linjan dysplasia
|
|
RCMD 2016: MDS-MLD tai MDS-RS-MLD |
<11 |
sytopeniat |
< 5 |
>10 % kahden tai useamman linjan soluista dysplastisia, ei Auerin sauvoja ±15% rengassideroblasteja 2016: >=5% jos SF3B1 -mutaatio |
|
RAEB-1 2016: MDS-EB-1 |
<51,2 |
sytopeniat |
5-92 |
yhdessä tai useammassa linjassa dysplasiaa, ei Auerin sauvoja 2016: 0-3 dysplastista linjaa |
|
RAEB-2 2016: MDS-EB-2 |
5-19 |
sytopeniat |
10–19 |
yhdessä tai useammassa linjassa dysplasiaa, Auerin sauvoja voi olla 2016: 0-3 dysplastista linjaa |
|
MDS-U |
<11 |
sytopeniat |
< 5 |
MDS:aan viittaavaan kromosomipoikkeamaan (kts. Table 6 linkkinä olevassa kirjallisuusviitteessä) liittyvänä hyväksytään <10 %:n dysplasia yhdessä tai useammassa linjassa |
|
MDS |
<1 |
anemia, |
< 5 |
megakaryosyyteissä aliliuskoittumista, ei Auerin sauvoja 2016: del(5q) alone or with 1 additional abnormality except -7 or del(7q) |
WHO 2016: Arber DA et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016:127:2391-2405. (https://www.ncbi.nlm.nih.gov/pubmed/27069254)
Brunning RD, Porwit A, Orazi A, ym. Myelodysplastic syndromes. Kirjassa: Swerdlow SH, Campo E, Harris NL, toim. WHO Classification of Tumors of Hematopoietic and Lymphoid Tissues. Lyon: IARC, 2008; 88-107.
1. Jos veressä on blasteja 2-4 %, luokitus on RAEB-1, vaikka luuytimen blastiosuus on < 5 %.
Jos veressä on blasteja 1 %, luokitus on MDS-U.
2. Auerin sauvojen esiintyminen vie luokituksen RAEB-2:een
RCUD refraktaarinen sytopenia, jossa yhden linjan dysplasia
RA refraktaarinen anemia
RN refraktaarinen neutropenia
RT refraktaarinen trombosytopenia
RARS refraktaarinen anemia, jossa rengassideroblasteja
RCMD refraktaarinen anemia, jossa monilinjainen dysplasia
RAEB-1 refraktaarinen anemia, jossa blastiylimäärä-1
RAEB-2 refraktaarinen anemia, jossa blastiylimäärä-2
MDS-U luokittelematon MDS
MDS del(5q) MDS, jossa ainoana muutoksena 5q-
MDS-SLD MDS with single lineage dysplasia
MDS-MLD MDS with multilineage dysplasia
MDS-RS MDS with ring sideroblasts
MDS-RS-SLD MDS-RS with single lineage dysplasia
MDS-RS-MLD MDS-RS with multilineage dysplasia
MDS-EB MDS with excess blasts
MDS-U MDS, unclassifiable
IPSS
IPSS
| 0 | 0,5 | 1 | 1,5 | 2 | |
| Luuytimen blastimäärä (%) | <5 | 5-10 | - | 11-20 | 21-30** |
| Karyotyyppi |
Pieni riski normaali -Y ainoana 5q- ainoana 20q- ainoana
|
Keskikorkea riski muut poikkeavuudet |
Suuri riski ≥ 3 poikkeavuutta kromosomin 7 mikä tahansa poikkeavuus
|
||
| Sytopeniat* | ei yhtään tai 1 | 2 tai 3 | |||
|
*Hb<100 g/L; B-Neutr<1,5x109/L; tromb<100x109/L **Nykyisen WHO-luokituksen mukaan ei enää MDS, vaan akuutti leukemia |
|||||
Keskimääräinen elinaika diagnoosista ja aika transformaatioon AML:ksi (vuosia)
| IPSS-pisteet | Riskiluokka | Potilaita (%) |
Ikä ≤ 70v Elinaika |
Ikä > 70v Elinaika |
Aika, jossa 25%:lle AML-evoluutio (v) |
| 0 | matala | 31 | 9,0 | 3,9 | 9,4 |
| 0,5-1 | keskikorkea-1 | 39 | 4,4 | 2,4 | 3,3 |
| 1,5-2 | keskikorkea-2 | 22 | 1,3 | 1,2 | 1,1 |
| ≥ 2,5 | korkea | 8 | 0,4 | 0,4 | 0,2 |
WPSS-ennusteluokitus
|
|||||||||||||||||||||||||
NOTE. Risk groups were as follows: very low (score = 0), low (score = 1), intermediate (score = 2), high (score = 3 to 4), and very high (score = 5 to 6).
Abbreviations: MDS, myelodysplastic syndrome; RA, refractory anemia; RARS, refractory anemia with ringed sideroblasts; 5q–, myelodysplastic syndrome with isolated del(5q) and marrow blasts less than 5%; RCMD, refractory cytopenia with multilineage dysplasia; RCMD-RS, refractory cytopenia with multilineage dysplasia and ringed sideroblasts; RAEB-1, refractory anemia with excess of blasts-1; RAEB-2, refractory anemia with excess of blasts-2.
* Karyotype was as follows: good: normal, –Y, del(5q), del(20q); poor: complex (≥ three abnormalities), chromosome 7 anomalies; and intermediate: other abnormalities.
† RBC transfusion dependency was defined as having at least one RBC transfusion every 8 weeks over a period of 4 months.
Seuranta ja vastearvio
Seuranta ja vastearvio
Seuranta
Matalamman riskiryhmän MDS (IPSS matala ja keskikorkea-1)
- Oireetonta potilasta seurataan verenkuvan avulla 2-4 kk välein. Etenkin iäkkäiden potilaiden seuranta voidaan toteuttaa terveyskeskuksessa tai aluesairaalassa. Potilaita, joiden kohdalla allogeeninen kantasolujensiirto voi tulla kyseeseen, seurataan keskussairaalassa tai yliopistollisessa keskussairaalassa.
Korkeamman riskiryhmän MDS (IPSS keskikorkea-2 ja korkea)
- Korkeamman riskin potilaille tulee harkita hoidon aloitusta, ja seuranta on siten yksilöllistä (kts. Hoito-osio jäljempänä).
Hoidon aloittamisaiheet:
- oireinen sytopenia (yleensä anemia, Hb < 100 g/l)
- suureneva ytimen blastiosuus (>10-15%)
- korkeamman riskin tauti (IPSS keskikorkea-2 ja korkea)
Hoitovasteen kriteerit MDS:ssa International Working Groupin (IWG) mukaan
(CR- tai PR-vasteen keston oltava korkeamman riskin MDS:ssa vähintään 4 viikkoa, joskaan 1 kk kuluttua otettavaa luuydinnäytettä ei välttämättä vaadita. Matalamman riskin MDS:ssä vasteen (lähinnä HI) tulisi kestää vähintään 8 viikkoa.)
|
Täydellinen vaste (CR)
|
Myeloblasteja < 5 % luuytimen soluista, kypsyminen kaikilla solulinjoilla normaalia. Solumorfologia voi olla dysplastista. Verenkuva:
|
|
Osittainen vaste (PR) |
CR:n kriteerit täyttyvät kaikkien ennen hoitoa todettujen poikkeavien löydösten osalta paitsi
Solukkuudella tai morfologialla ei ole merkitystä. |
|
Sytogeneettinen vaste |
Täydellinen vaste
Osittainen vaste
|
|
Verenkuva-arvojen korjaantuminen (HI) (lähtötaso kahden hoitoa edeltävän, vähintään viikon välein mitatun, lukeman keskiarvo) (matalamman riskin MDS:ssä korjaantuminen vähintään 8 viikoksi) |
Hemoglobiinivaste, lähtötaso < 110 g/l
Trombosyyttivaste
Neutrofiilivaste, lähtötaso < 1.0x109/l
|
|
Stabiili tauti |
PR-vastetta ei ole saavutettu, mutta tauti ei ole edennyt >8 viikon aikana |
|
Epäonnistunut hoito (failure) |
Hoidon aikainen kuolema tai taudin eteneminen, mikä ilmenee sytopenioiden syvenemisenä, luuytimen blastiosuuden lisääntymisenä tai taudin etenemisenä korkeamman riskin FAB-alaryhmään. |
|
Taudin eteneminen |
Muutos luuytimen blastimäärässä, kun lähtötaso
Jokin seuraavista:
|
|
Relapsi täydellisestä tai osittaisesta vasteesta |
Vähintään yksi seuraavista
|
Cheson BD, Greenberg PL, Bennett JM, ym. Clinical application and proposal for modification of the International Working Group (IWG) response criteria in myelodysplasia. Blood. 2006;108:419-25.
Hoitovasteen arviointi
Diagnoosivaiheessa tehtyjen tutkimusten perusteella valitaan potilaskohtaiset seurantatutkimukset (sytogenetiikka, molekyyligenetiikka, immunofenotyypitys), mikäli sellaisia on olemassa.
Taudin status
Taudin status
Vastearvion yhteydessä pyritään tautitaakan arvio ja taudin tilanne luokittelemaan oheisen taulukon mukaisesti (SHR-muuttuja: status-mds). Taulukosta valitaan arviointihetkellä oleva paras vaste.
|
Koodi |
Lyhenne |
Nimike |
Määritelmä |
|
0 |
Dg |
Diagnoosivaihe |
|
|
1 |
CR-MRDneg |
Remissio, jäännostauti negatiivinen |
|
|
2 |
CR-MRDpos |
Remissio, jäännostauti positiivinen |
|
|
3 |
CCR |
Sytogeneettinen remissio (complete cytogenetic response) |
|
|
4 |
pCR |
Osittainen sytogeneettinen vaste (partial cytogenetic response) |
|
|
5 |
CR |
Morfologinen remissio (complete remission) |
|
|
6 |
PR |
Osittainen vaste (partial remission) |
(esimerkki: blastiosuus 15%-> 6%)
|
|
7 |
HI |
Verenkuva-arvojen korjaantuminen (hematologic improvement) (lähtötaso kahden hoitoa edeltävän, vähintään viikon välein mitatun, lukeman keskiarvo) (matalamman riskin MDS:ssä korjaantuminen vähntään 8 viikoksi) |
(esim: B-neut 0,3-> 0,6) |
|
8 |
Stabiili |
Stabiili tauti (stable disease) |
|
|
9 |
Progressio |
Taudin eteneminen (progressive disease) |
|
|
10 |
Relapsi |
Relapsi täydellisestä tai osittaisesta vasteesta |
|
|
90 |
Exitus-progressio |
Exitus, progressio |
|
|
91 |
Exitus-infektio |
Exitus, infektio |
|
|
92 |
Exitus-muu |
Exitus, muu syy |
|
|
99 |
Exitus-tuntematon |
Exitus, syy tuntematon |
|
|
999 |
Poistunut seurannasta |
Lost to follow-up |
|
Hoito
- Kirjaudu tai rekisteröidy kommentoidaksesi
Hoito
- Hoidon valintaan vaikuttavat IPSS-luokitus (matalampi tai korkeampi riski), potilaan ikä ja hänen liitännäissairautensa ja yleinen raihnaisuuden (fragiliteetin) aste.
- Mikään lääkehoidoista ei ole kuratiivinen, jonka vuoksi potilaan kanssa tulee puhua hoidon tavoitteista
- Matalamman riskin taudeissa hoidon tavoitteina ovat sytopenioista johtuvien oireiden korjaaminen ja elämänlaadun parantaminen. Ensilinjan hoitona anemiaan käytetään yleensä kasvutekijähoitoa (erytropoietiini +- G-CSF) ja pienellä osalla potilaista immunosuppressiivista hoitoa. Toisen linjan hoitona tulee 5q- -oireyhtymässä harkittavaksi lenalidomidi ja muilla joskus atsasitidiinihoito, joskaan sillä ei ole virallista käyttöaihetta matalamman riskin MDS:ssä. Osalla hoitoresistenteistä potilaista tai etenevässä taudinkuvassa harkitaan allogeenista kantasolujensiirtoa. Tukihoitoja käytetään muiden hoitojen rinnalla, joskus etenkin iäkkäillä yksinomaisena hoitona.
- Korkeamman riskin taudeissa selvitetään heti dg-vaiheessa allogeenisen kantasolujensiirron mahdollisuus huomioiden potilaan ikä ja liitännäissairaudet. Jos siirto ei tule kyseeseen, ensisijainen hoito on atsasitidiini, jota käytetään tarvittaessa myös kantasolujensiirtoa edeltävästi. Joskus käytetään intensiivistä solunsalpaajahoitoa, mutta matala-annoksista solunsalpaajahoitoa nykyään harvemmin. Hoitojen tavoitteena on elossaoloennusteen parantaminen ja leukemisoitumisriskin pienentäminen.
- Ennusteellisesti merkittävien mutaatioiden osoittaminen saattaa tulevaisuudessa osaltaan ohjata hoitovalintaa.
- vastearviossa auttavat International Working Groupin (IWG) kriteerit (tähän sivuston sisäinen linkki suomenkieliseen taulukkoon, tämä kirjallisuuslinkki siirretään taulukon otsikkoon)
1. Matalamman riskin (IPSS Score ≤ 1.0 tai IPSS-R Score ≤ 4.5) hoidot:

1.1 Sytopenioiden tukihoidot
1.1.1 Anemia
- anemiaan liittyy huonontunut elämänlaatu ja suurentunut sydäntapahtumavaara
- punasolujensiirrot oireiseen anemiaan (B-Hb<80-90 g/l) huomioiden se, että ne aiheuttavat rautakuorman kertymistä
- seuranta: B-PVK+T tarpeen mukaan, P-Ferrit ja transfuusiotarpeen rekisteröinti 3 kk välein
1.1.2 Trombosytopenia
- trombosyyttiensiirtoja vain merkittäviin vuotoihin, ei ennaltaehkäisevästi (poikkeuksena toimenpiteet ja MDS:n hoitoihin liittyvät trombosytopeniat)
- traneksaamihaposta voi olla hyötyä vuotojen ehkäisyssä ja hoidossa
- trombopoietiiniagonisteja tutkittu vaihtelevin tuloksin, Cochrane-katsauksessa (Desborough M et al. Cochrane Database Syst Rev 2016:2016) ei riittävää osoitusta romiplostiimin tai eltrombopagin suosittelemiselle
- eltrombopagia (suuremmilla annoksilla kuin ITP:ssä) voidaan harkita matalamman riskin MDS:ssa ongelmallisen trombosytopenian hoidossa, kun Bm-blastit <5%, mutta ei ole virallinen käyttöaihe
1.1.3 Infektiot
- infektioiden nopea ja tehokas hoito on keskeistä
- rutiininomaisesta valkosolukasvutekijäprofylaksista ei hyötyä oireettomalla neutropeniapotilaalla
- käytetään hoidettaessa neutropeenisen potilaan infektioita, toistuvien vakavien infektioiden estohoidossa ja syvän neutropenian estohoitona atsasitidiinia saavilla (joskin neutrofiilitasolla >0,5 infektioita esiintyy harvoin)
- potilaat tulisi rokottaa pneumokokkia ja influenssaa vastaan ja ohjeistaa hyvään käsihygieniaan
1.2 Muut tukihoidot
1.2.1 Raudan kelaatiohoito
Indikaatio:
- jatkuva punasolujensiirtoja vaativa anemia ja
- odotettavissa oleva elinaika >2 vuotta (eli IPSS matalamman riskin tauti) sekä
- P-Ferrit > 1500 µg/l (yleensä noin 25 punasoluyksikön annon jälkeen)
- Maksan MRI T2* -kuvaus valikoiduissa tapauksissa maksan rautavarastojen määrittämiseksi
- allosiirtoon menevillä varhaisessa vaiheessa, jo estämään ennalta rautakuorman kehittymistä
Toteutus:
Deferasiroksi (ensisijainen)
- aloitusannos 5-10 mg/kg kerran päivässä, nosto asteittain ad 20-40 mg/kg/vrk (tyhjään mahaan vähintään 30 min ennen ateriaa)
- ruoansulatuskanavan haittavaikutuksia ja kreatiniinin suurenemista 25%:lle
- kreatiniinin seuranta alkuun viikottain kuukauden ajan, myöhemmin kuukausittain
- jos kreatiniini suurenee ad 2x viitevälin yläraja, tauotus ja jatkossa aloitus pienemmällä annoksella
- lääkkeen ottaminen ruoan kanssa vähentää vatsaoireita ja ripulia
- Novartiksen edustajan mukaan dispergoituva tabletti korvautuu keväästä 2017 lähtien kalvopäällysteisellä nieltävällä kapselilla, jonka GI-siedettävyys on parempi
Desferrioksamiini
- 5-7 tunnin jatkuva infuusio pumpulla ihon alle, 5-7 vrk/viikko
- annos yleensä 20-60 mg/kg/vrk
- C-vitamiinilisä 1 kk hoidon aloituksesta (max 200 mg/vrk), jollei sydämen vajaatoimintaa
Tavoite ja hoitovaste: P-Ferrit-tavoite kelaatiohoidossa on < 1000 µg/l. Korkeaan ferritiiniin on todettu liittyvän lyhentynyt elinaika. Ei kuitenkaan tiedetä, pidentääkö raudan kelaatiohoidolla aikaansaatu plasman ferritiinitason pieneneminen elinaikaa.
1.2.2 Kasvutekijähoito erytropoietiinivalmisteilla
Indikaatio:
- oireinen anemia (Hb < 100 g/l) matalamman riskin raudissa (Bm-blastit <10%), kun muut anemian syyt poissuljettu ja S-EPO < 500 U/l ja/tai punasolujensiirtotarve < 2 yks/kk
Toteutus:
- epoetiini: aloitusannos on 30 000 KY/vk sc (450 KY/kg/vk) . Jos Hb ei suurene vähintään 15 g/l kahdeksassa viikossa, annos kaksinkertaistetaan
- darbepoetiini: yleensä 500 ug sc kolmen viikon välein tai 300 ug kahden viikon välein. Jos Hb ei suurene vähintään 15 g/l kahdeksassa viikossa, tihennetään annostusta ad 300 ug kerran viikossa
- pienipainoisilla tai munuaisten vajaatoiminnassa annokset yleensä pienemmät
- ellei kaksinkertaistetullekaan EPO-annokselle vastetta, hoitoon voidaan harkita liitettäväksi matala-annoksinen G-CSF, esimerkiksi filgrastiimi 12-30 MU (120-300 ug) 2-3 kertaa viikossa sc. Valkosolukasvutekijähoidossa pyritään selkeään neutrofiilinousuun, tasolle 6-10x109/l
- RARS:ssa aloitetaan suoraan EPO + G-CSF -yhdistelmällä (?, tarkistetaan tulossa olevasta pohjoismaisen ohjeen päivityksestä, ohjeistetaanko vielä näin, ELN ei ohjeista)
- seuraa harvakseltaan ferritiiniarvoa: lisää rautalääkitys, jos ferritiini matala tai fP-Trfesat < 20%
- jos Hb suurenee > 120 g/l, pienennetään annoksia tai harvennetaan pistoksia (tarvittaessa tauotus ja uudelleenaloitus 50%:n annoksella, kun Hb <120 g/l)
Hoitovaste:
- korjaa anemiaa noin puolella potilaista, parantaa elämänlaatua, saattaa pidentää elinaikaa, myöhentää transfuusiotarpeen alkamista
- vaste saavutetaan yleensä 12 viikossa, mutta viimeistään 16 viikossa, vasteen keston mediaani noin 2 vuotta
- jos vastetta ei saavuteta (joko punasolusiirtoriippumattomuus tai stabiilissa anemiassa Hb:n suureneminen >15 g/l), hoito lopetetaan tehottomana ja harkitaan luuydinmorfologian tutkimista mahdolisen progression varalta
1.3 Immunosuppressiiviset lääkkeet
Osalla RA- tai RCMD-potilaista sytopenioiden taustan arvellaan olevan immunologinen, samantyyppinen kuin aplastisessa anemiassa.
Indikaatio
- erytropoietiinihoidolle resistentit matalan riskin alle 60 (-70) -vuotiaat potilaat, joilla on vaikea sytopenia, hypoplastinen ydin, ei blastiylimäärää eikä korkean riskin kromosomipoikkeavuuksia
- HLA DR15 -positiivisuus tai PNH-klooni lisäävät vasteen todennäköisyyttä ainakin yli 50-vuotiailla
Toteutus
- antilymfosyyttiglobuliini (ATG) yksin tai yhdessä siklosporiinin kanssa
- aplastisessa anemiassa hevosen ATG (Atgam®) 40 mg/kg/vrk 4 vrk:n ajan tutkitusti tehokkain, mutta MDS:ssa mahdollista antaa vaihtoehtoisesti kanin ATG (Thymoglobuline®) 3,75 mg/kg/pv päivinä 1-5 tai hevosen ATG (Lymphoglobulin®) 15 mg/kg/pv päivinä 1-4
- kombinoidaan siklosporiini 3-5 mg/kg/vrk jaettuna kahteen osaan (B-CyA -tavoite 150-250 µg/l) vähintään 3-6 kk ajan, hoitoon vastaavassa taudissa usein pitkäaikaisena ylläpitohoitona
- seerumitaudin ehkäisemiseksi prednisoloni 1 mg/kg/vrk päivinä 1-10 asteittain päivinä 11-24 purkaen
- iäkkäillä voidaan harkita siklosporiinia monoterapiana ATG:n toksisuuden vuoksi
- pneumokystisprofylaksi 6 kk
- vaihtoehtona ATG:lle voidaan joskus harkita alemtutsumabia 10 mg/pv iv 10 pv (Neukirchen J et al. Ann Hematol 2014;93:65-9)
Hoitovaste antilymfosyyttiglobuliinihoidolle
- vaste 30-50%:lle
- anemian lisäksi myös muissa sytopenioissa korjautumista
- ilmenee keskimäärin 2,5 kuukaudessa, voi tulla vasta 3-6 kk:ssa
- vasteen kesto keskimäärin 3 vuotta
1.4 Lenalidomidi
Indikaatiot
- FDA on hyväksynyt lenalidomidille käyttöindikaation matalamman riskin MDS:ssä, jossa on kromosomipoikkeavuutena 5q- joko yksin tai muiden poikkeavuuksien kanssa
- EMEA on hyväksynyt lenalidomidin punasolusiirtoriippuvaisille pienen tai Int-1-riskiryhmän MDS-potilaille, joilla 5q- on yksittäisenä sytogeneettisena poikkeavuutena, kun muut hoitovaihtoehdot ovat riittämättömiä tai eivät sovi potilaan hoitoon
- jos luuydinbiopsian immunohistokemiassa voimakas tumien p53-värjäytyminen, on AML-progressioriski suurempi, MDS-004-tutkimuksessa 27.5%/2 vuotta (versus 3.6% IHC-p53-negatiivisilla)
- ei korvattavuutta Suomessa MDS-indikaatiolla (vuonna 2016)
Toteutus
- ennen hoitoa tulisi tutkia TP53-geenin mutaatiostatus joko luuydinbiopsian immunohistokemialla tai sekvensoinnilla; mutaatio todetaan 20%:lla MDS 5q- -potilaista, näillä potilailla taudin ennuste huonompi ja lenalidomidivasteet lyhyempiä
- aloitusannos 10 mg/pv päivinä 1-21 (10 mg/pv annos tehokkaampi kuin 5 mg), syklien pituus 28 pv
- annosta pienennettävä munuaisten vajaatoiminnassa
- alkuvaiheen neutro- ja trombosytopenioita n. 50%:lla, esiintyminen ennustaa hyvää hoitovastetta
- kahden ensimmäisen hoitosyklin aikana verenkuvaseuranta viikottain
- tarvittaessa annosreduktioharkinta, G-CSF-harkinta
- rutiininomaista tromboosiprofylaksiaa ei tarvita
Hoitovaste
- 5q- oireyhtymässä 67% punasolujensiirroista riippumattomiksi, 45%:lle täydellinen sytogeneettinen vaste
- vasteen ilmaantumisajan mediaani 4.4 viikkoa, vastearvioon tarvitaan vähintään 3-4 sykliä
- hoitoon vastaavilla hoitoa jatketaan, vasteen kesto keskimäärin 2,2 vuotta
- täydellisessä sytogeneettisessä vasteessa lopettaneilla hoitovaste on voinut säilyä ilman lääkettäkin
- jatkoseuranta: B-PVK+T+Neutrofiilit 3 kk välein, luuytimen hematologinen kromosomitutkimus 6 kk välein
- satunnaistetussa non-5q- MDS-tutkimuksessa 26%:lle potilaista punasolusiirtoriippumattomuus, vasteen mediaanikesto 41 viikkoa (Raza et al. Blood 2008;111:86-93)
1.5 Allogeeninen kantasolujensiirto
Indikaatiot
- < 70-vuotias hyväkuntoinen matalamman riskin potilas, jolla muuhun hoitoon reagoimaton vaikea sytopenia, huonon ennusteen kromosomilöydös tai suureneva ytimen blastiosuus
- IPSS-R-luokitus voi antaa lisätietoa riskistä; sen keskiriskiryhmässä mutaatioanalyysi saattaa lähitulevaisuudessa auttaa siirtoon menevien potilaiden valinnassa (TP53, ASXL1, RUNX1 ja EZH2 liittyvät huonoon ennusteeseen MDS:ssa
- toteutus ja hoidon vaste: kts. korkeamman riskin hoidot: allogeeninen kantasolujensiirto
- konsultoidaan kantasolujensiirtokeskusta
1.6 Atsasitidiini
- kts. indikaatiot korkeamman riskin kohdalta
- voidaan harkita, jos EPO-hoito ja/tai immunosuppressiivinen hoito eivät tehoa tai tule kyseeseen eikä potilas sovellu allogeeniseen kantasolujensiirtoon (kts. siirtoindikaatiot kohdasta Allogeeninen kantasolujensiirto) etenkin jos potilaalla on vaikea sytopenia tai korkean riskin kromosomilöydös tai blastiylimäärä lisääntyy
- annos vakioannos 75 mg/m2 sc seitsemän pv ajan 28 pv:n sykleissä, myös 5 vrk:n annostelua voi harkita (Lyons RM et al. JCO 2009)
- EPO-resistenteillä 40-50%:lle vaste anemiaan; elinaikahyötyä ei ole toistaiseksi osoitettu
2. Korkeamman riskin (IPSS >/= 1,5 tai IPSS-R >/=4,5) hoidot:
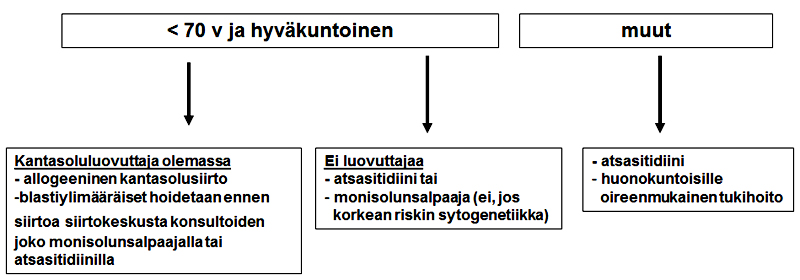
2.1 Hypometyloivat hoidot
2.1.1 Atsasitidiini
- hypometyloiva lääke, joka indusoi kasvuun, erilaistumiseen ja apoptoosiin liittyviä geenejä
- ei paranna MDS:aa, mutta hidastaa sen kulkua
- korkeamman riskin taudissa ensilinjan hoito nillä, joilla ei suoraan edetä kantasolujensiirtoon
- ainoa lääke, jolla on faasin III tutkimuksessa osoitettu elinajan piteneminen MDS:ssa verrattuna tukihoitoon, matala-annoksiseen solunsalpaajahoitoon tai intensiiviseen solunsalpaajahoitoon
Indikaatio
- FDA hyväksynyt käyttöaiheeksi matalamman ja korkeamman riskin MDS:n, mutta EMEA ainoastaan korkeamman riskin MDS:n (ja AML:n)
- voidaan käyttää myös ennen allogeenista kantasolujensiirtoa pienentämään ytimen korkeaa blastiosuutta, etenkin potilailla, joilla on korkean riskin kromosomipoikkeavuus (ei ole virallinen indikaatio)
- 75 mg/m2/vrk sc 7 pv kuurein, syklin pituus 28 vrk
- epävirallisesti käytetään myös annostelua 75mg/m2/vrk päiväaikataululla 5-0-2 (=viikonlopputauko) tai 100 mg/m2/vrk 5 vuorokauden ajan, mutta näiden annostelutapojen tehosta ei ole vertailua vakioannostukseen
- vaste tulee hitaasti, suositellaan (4)-6 hoitojaksoa ennen vastearviota luuytimestä
- vasteista 50% saavutetaan kolmen, 80% kuuden ja 90% yhdeksän syklin jälkeen
- jos saavutetaan vaste, hoitoa suositellaan jatkettavaksi tautiprogressioon saakka
- haittavaikutuksia eniten kahden ensimmäisen syklin aikana
- myelosuppressio, pahoinvointi, GI-oireet, injektiokohdan ärsytys (lievitettävissä helokkiöljyllä tai tulehduskipulääkegeelillä)
- verenkuvakontrolli viikoittain 3 ensimmäisen syklin aikana, sen jälkeen 2 vk välein
- alkuvaiheen sytopenioista huolimatta ei annosreduktioita eikä mielellään myöskään hoitovälien pidennyksiä kolmen ensimmäisen syklin aikana, etenkään edenneessä MDS:ssa
- myöhempien sytopenioiden yhteydessä luuydintutkimus: jos myelosuppressiota ilman viitteitä tautiprogressiosta, annosreduktio esim. ad 50 mg/m2/vrk tai hoitoväli 5 viikkoon
Vaste
- 50%:lla hoitovaste, jonka kesto keskimäärin 13,6 kk
- punasolujen siirtotarve lakkaa 45%:lla
- trombosyyttiluvut korjautuvat 20-30%:lla
- CR- ja PR -vasteita 11-29%:lla
- pidensi elinaikaa faasin III tutkimuksessa 9,5 kk
- kaikentyyppiset hoitovasteet assosioituivat elinaikaetuun
- taudin leukemisoituminen hidastui
- vaste ei riippunut potilaan iästä (myös >75-vuotiaat hyötyivät), FAB/WHO -tyypistä, ytimen blastimäärästä tai karyotyypistä (myös -7/del7q -potilaat vastasivat hoidolle)
- haittavaikutukset kohtuullisen vähäisiä ja infektioita < 20%:lla
- vaste menetetään puolella potilaista 1-1,5 v kuluessa
- kun tauti etenee/relapsoituu, ennuste huono (keskimäärin vain 6.5 kk)
- progressioon/relapsiin ei tällä hetkellä hyviä hoitovaihtoehtoja
2.1.2 Desitabiini
- vasteet samanlaisia kuin atsasitidiinilla korkeamman riskin taudissa, mutta elinaikaetua ei ole osoitettu
- FDA hyväksynyt MDS-indikaatiolla; EMEA ainoastaan AML-indikaatiolla
- annos 20 mg/m2 5 pv (20 mg/m2 10 pv:n annostuksella saatu hyviä vasteita korkean riskin kromosomi- ja TP53-muutoksissa)
- vaihto atsasitidiinista desitabiiniin harvoin hyödyllistä
2.2 Intensiivinen solunsalpaajahoito
- yleisimmin antrasykliini-AraC -yhdistelmä (sytarabiini joko jatkuvana tai kahdesti päivässä)
Indikaatio
- <65-vuotiaille korkeamman riskin potilaille
- vastetta ennustavat: B-Leuk <4x109/l, ei-korkean riskin kromosomilöydös ja normaali LD
- harkitaan, jos atsasitidiinihoidolle ei saada vastetta (korkean riskin kromosomilöydöspotilaat eivät kuitenkaan hyödy)
- voidaan käyttää ennen allogeenista kantasolujensiirtoa pienentämään ytimen blastiosuutta
- pitkittyneen luuydinlaman vaara, hoidon mortaliteetti 10-20%
Hoitovaste
- CR 40-60%, kesto 10-12 kk
- 10%:lle pitkäaikainen CR (nuoria potilaita, joilla normaali karyotyyppi)
- ei elinaikahyötyä, ellei päästä CR-tilanteeseen ja sen jälkeen allogeeniseen kantasolujensiirtoon
2.3 Matala-annoksinen solunsalpaaja
- harkitaan allogeenisen kantasolujensiirron ulkopuolella oleville korkeamman riskin taudissa, jos atsasitidiiniä tai monisolunsalpaajahoitoa ei voi käyttää
- ei vaikutusta elinaikaan tai leukemisoitumisaikaan
- vasteet lyhyitä
Matala-annoksinen Ara-C
- annos 20mg/m2/pv sc 14-21 pv, kuukauden välein
- hoitovasteet: CR 15-20%, PR 15-20% (korkean riskin kromosomilöydös huonontaa vastetta)
- ei elinaikaetua
2.4 Allogeeninen kantasolujensiirto
Indikaatio
- <70-vuotias korkeamman riskin potilas, jolla ei ole merkittävää komorbiditeettia
- alle 50-vuotiailla tai luuytimenvajaatoimintaoireyhtymän fenotyypin tai viitteellisen sukuanamneesin yhteydessä tulisi poissulkea periytyvät MDS-alttiudet ja telomeropatiat, koska ne vaikuttavat mahdollisen sisarusluovuttajan valintaan ja siirron esihoitoon
- kantasolujensiirtokeskuksen konsultaatio
- päivitetty kantasolujensiirto-riskiluokitus (Sorror ML, Blood 2013); netissä on linkki siihen pohjautuvaan riskilaskuriin: http://www.hctci.org/
Toteutus
- nuoremmille potilaille täysimittainen esihoito
- vanhemmille potilaille tai niille, joilla on merkittäviä oheissairauksia, kevennetty esihoito, esimerkiksi treosulfaanipohjainen
- jos ytimen blastiosuus >10%, ennen siirtoa intensiivinen solunsalpaajahoito tai atsasitidiini
Hoitovaste
- keskimäärin 35-40% pitkäaikaiseen remissioon
- sytogenetiikka ja ytimen blastiosuus tärkeimmät relapsiriskiä ennustavat tekijät
- pitkäaikaistulokset (OS) selvästi paremmat matalamman riskin MDS:ssa (IPSS-Low 75%, IPSS-Int-1 60%) kuin korkeamman riskin taudissa (IPSS-Int-2 45% ja IPSS-High 30%)
- kompleksisessa karyotyypissä ja sekundaarisessa MDS:ssa ennuste siirrollakin huono (10%)
- toimenpidemortaliteetti 15-25% ja relapsiriski 20-30% (relapsi yleensä kolmen vuoden sisällä)
2.5 Tutkimuksissa olevia hoitoja
2.5.1 Hypometyloivat lääkkeet
Atsasitidiini
- matalamman riskin MDS:ssa
- allogeenisen kantasolujensiirron jälkeisessä relapsissa
- ylläpitohoidossa kemoterapian jälkeen
- per os -annostelu
- tutkimuksia useissa kombinaatioissa, mm.:
- atsasitidiini + lenalidomidi
- atsasitidiini + histonideasetylaation estäjä
- atsasitidiini + anti-PD-1
Guadesitabiini, SGI-110
- korkeamman riskin taudissa
- puoliintumisaika 4,5 kertaa pitempi kuin desitabiinilla
2.5.2 Immunomoduloivat lääkkeet
Lenalidomidi
- matalamman riskin ei-5q- -MDS-potilailla
- neljäsosalla punasolusiirtotarve lakkaa
- vähemmän hoitotoksisuutta kuin 5q- -oireyhtymää hoidettaessa
- erytropoietiini + lenalidomidi: punasolujensiirtotarvevasteet lisääntyivät 25%:sta 40%:iin
- korkeamman riskin MDS:ssa
- korkea blastimäärä, trombosyytit <50 ja kompleksinen karyotyyppi ennustavat huonoa vastetta
2.5.3 Kinaasi-inhibiittorit
Rigosertibi (polo-like kinaasi- (PLK) ja PI3-kinaasi-inhibiittori)
- tutkimuksia etenkin hypometyloivan lääkkeen jälkeisessä relapsissa ja korkean riskin sytogenetiikan omaavilla potilailla
Volasertibi (polo-like kinaasi-inhibiittori)
2.5.4 TGF-ß -antagonistit
Luspatersepti
- matalamman riskin taudissa
- inhiboi Smad2/3 -signalointia ja edistää kypsien punasolujen vapautumista verenkiertoon
- punasoluvaste 40%:lla, RA-MDS:ssa (SF3B1-mutaatio+) 67%:lla
- annostelu subkutaanisina pistoksina kolmen viikon välein
Sotatersepti
- vasteet kuten luspaterseptilla
2.5.5 Solunsalpaajat
Klofarabiini ja sapasitabiini (po nukelosidianalogit)
- korkeamman riskin MDS:ssa vasteita 40-50%.lle
2.5.6 Muut
Imetelstaatti (telomeraasi-inhibiittori)
- matalamman riskin taudin anemiassa
Eksatiostaatti (GSTP-1 -inhibiittori)
- matalamman riskin taudissa
Kantasolujensiirto
Kantasolujensiirto
Allogeeninen kantasolujensiirto voi olla aiheellinen hyväkuntoisella matalamman riskin potilaalla, jolla on muuhun hoitoon reagoimaton vaikea sytopenia, huonon ennusteen kromosomilöydös tai suureneva ytimen blastiosuus ja korkeamman riskin potilaalla, jolla ei ole merkittävää komorbiditeettia.
Alaryhmissä, joissa ei ole blastiylimäärää, siirtojen tulokset ovat selvästi paremmat kuin blastiylimääräisissä alaryhmissä. Jos potilaalla on blastiylimäärä > 10%, tauti pyritään hoitamaan remissioon intensiivisellä kemoterapialla tai atsasitidiinilla ennen siirtoa.
Täysimittaisella esihoidolla toteutettavassa allogeenisessa kantasolujensiirrossa potilaan on oltava alle 61-vuotias. Kevennetyllä esihoidolla allogeenisia kantasolujensiirtoja voidaan yksilöllisesti harkiten tehdä 70 vuoden ikään saakka sekä potilaille, joilla on merkittäviä oheissairauksia.
Kirjallisuutta
- Kirjaudu tai rekisteröidy kommentoidaksesi
Kirjallisuutta
Linkit eurooppalaiseen ja pohjoismaiseen ohjeeseen
https://www.ncbi.nlm.nih.gov/pubmed/23980065
Pohjoismainen ohje NMDSG:n kotisivuilla:
Yleiskatsauksia
- Myelodysplastic syndromes. Tefferi A, Vardiman JW. N Engl J Med. 2009 Nov 5;361(19):1872-85. Review.
-
Current therapeutic approaches for patients with myelodysplastic syndromes. Greenberg PL. Br J Haematol. 2010 Jul;150(2):131-43. Epub 2010 May 5. Review.
- Optimal sequencing of treatments for patients with myelodysplastic syndromes. Itzykson R, Fenaux P. Curr Opin Hematol. 2009 Mar;16(2):77-83.
- How I treat patients with myelodysplastic syndromes. Stone RM. Blood. 2009 Jun 18;113(25):6296-303.
-
Clinical management of myelodysplastic syndromes: update of SIE, SIES, GITMO practice guidelines. Santini V, Alessandrino PE, Angelucci E, Barosi G, Billio A, Di Maio M, Finelli C, Locatelli F, Marchetti M, Morra E, Musto P, Visani G, Tura S. Leuk Res. 2010 Feb 11. [Epub ahead of print]
-
Pohjoismaisen MDS-työryhmän Nordic Care Programme 2014 Guideline, Issue 6
-
Diagnosis and treatment of primary myelodysplastic syndromes in adults. Recommendations fron the European LeukemiaNet. Malcovati L, Hellström-Lindberg E, Bowen D, Adès L, Cermak J, Del Cañizo C, Della Porta MG, Fenaux P, Gattermann N, Germing U, Jansen JH, Mittelman M, Mufti G, Platzbecker U, Sanz GF, Selleslag D, Skov-Holm M, Stauder R, Symeonidis A, van de Loosdrecht AA, de Witte T, Cazzola M. Blood. 2013;122(17):2943-64.
-
Guidelines for the diagnosis and management of adult myelodysplastic syndromes. Killick SB, Carter C, Culligan D, Dalley C, Das-Gupta E, Drummond M, Enright H, Jones GL, Kell J, Mills J, Mufti G, Parker J, Raj K, Sternberg A, Vyas P, Bowen D; British Committee for Standards in Haematology. Br J Haematol. 2014 Feb;164(4):503-25
-
Myelodysplastinen oireyhtymä - monikasvoinen luuytimen toimintahäiriö. Kauppila M, Ebeling F, Kuittinen T, Pelliniemi T-T, Poikonen E, Sankelo M, Tienhaara A, Siitonen T. Suom Lääkäril 2014;35:2099-104 (http://www.fimnet.fi/cgi-cug/brs/artikkeli.cgi?docn=000041618)
-
The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Arber DA, Orazi A, Hasserjian R, et al. Blood 2016;127:2391-405. (http://www.ncbi.nlm.nih.gov/pubmed/27069254)
Metylaation vähentämishoidot
-
Efficacy of azacitidine compared with that of conventional care regimens in the treatment of higher-risk myelodysplastic syndromes: a randomised, open-label, phase III study. Fenaux P, Mufti GJ, Hellstrom-Lindberg E, Santini V, Finelli C, Giagounidis A, Schoch R, Gattermann N, Sanz G, List A, Gore SD, Seymour JF, Bennett JM, Byrd J, Backstrom J, Zimmerman L, McKenzie D, Beach C, Silverman LR; International Vidaza High-Risk MDS Survival Study Group. Lancet Oncol. 2009 Mar;10(3):223-32. Epub 2009 Feb 21.
- Practical recommendations for hypomethylating agent therapy of patients with myelodysplastic syndromes. Steensma DP, Stone RM. Hematol Oncol Clin North Am. 2010 Apr;24(2):389-406.
- Novel approaches for myelodysplastic syndromes: beyond hypomethylating agents. Loaiza-Bonilla A, Gore SD, Carraway HE. Curr Opin Hematol. 2010 Mar;17(2):104-9. Review.
Rautakuorma, kelaatio
- Impact of iron overload in myelodysplastic syndromes. Fenaux P, Rose C. Blood Rev. 2009 Dec;23 Suppl 1:S15-9. Review.
- Iron chelation therapy in myelodysplastic syndrome - Cui bono? Tefferi A, Stone RM. Leukemia. 2009 Aug;23(8):1373.
Immunosuppressiiviset hoidot
- Cyclosporin A therapy in hypoplastic MDS patients and certain refractory anaemias without hypoplastic bone marrow. Jonásova A, Neuwirtová R, Cermák J, Vozobulová V, Mociková K, Sisková M, Hochová I. Br J Haematol. 1998 Feb;100(2):304-9
- Antithymocyte globulin for patients with myelodysplastic syndrome. Molldrem JJ, Caples M, Mavroudis D, Plante M, Young NS, Barrett AJ. Br J Haematol. 1997 Dec;99(3):699-705.
-
Antithymocyte globulin for treatment of the bone marrow failure associated with myelodysplastic syndromes. Molldrem JJ, Leifer E, Bahceci E, Saunthararajah Y, Rivera M, Dunbar C, Liu J, Nakamura R, Young NS, Barrett AJ. Ann Intern Med. 2002 Aug 6;137(3):156-63.
-
Successful treatment with cyclosporin A for myelodysplastic syndrome with erythroid hypoplasia associated with T-cell receptor gene rearrangements. Shimamoto T, Iguchi T, Ando K, Katagiri T, Tauchi T, Ito Y, Yaguchi M, Miyazawa K, Kimura Y, Masuda M, Mizoguchi H, Ohyashiki K. Br J Haematol. 2001 Aug;114(2):358-61.
-
Phase II study of rabbit anti-thymocyte globulin, cyclosporine and granulocyte colony-stimulating factor in patients with aplastic anemia and myelodysplastic syndrome. Garg R, Faderl S, Garcia-Manero G, Cortes J, Koller C, Huang X, York S, Pierce S, Brandt M, Beran M, Borthakur G, Kantarjian H, Ravandi F. Leukemia. 2009 Jul;23(7):1297-302.
Lenalidomidi
- List et al. NEJM
-
Practical recommendations on the use of lenalidomide in the management of myelodysplastic syndromes. Giagounidis A, Fenaux P, Mufti GJ, Muus P, Platzbecker U, Sanz G, Cripe L, Von Lilienfeld-Toal M, Wells RA. Ann Hematol. 2008 May;87(5):345-52.
-
Lenalidomide on alternative days is effective in myelodysplastic syndrome with 5q- deletion. Defina M, Rondoni M, Gozzetti A, Aprile L, Chitarrelli I, Fabbri A, Lauria F, Bocchia M. Br J Haematol. 2010 Feb;148(3):483-4.
TPO-agonistit
- Thrombocytopenia in Patients With Myelodysplastic Syndromes. Jeffrey Bryan, Elias Jabbour, Hillary Prescott, Hagop Kantarjian. Semin Hematol 2010;47(3):274-280.
Muut hoidot
-
Combination of 5-azacytidine and thalidomide for the treatment of myelodysplastic syndromes and acute myeloid leukemia. Raza A, Mehdi M, Mumtaz M, Ali F, Lascher S, Galili N. Cancer. 2008 Oct 1;113(7):1596-604.
Potilasohje
- Kirjaudu tai rekisteröidy kommentoidaksesi
Potilasohje
- MDS-opas:http://www.syopapotilaat.fi/pdf/mdsopas.pdf
- Suomen Lääkärilehdessä julkaistun MDS-artikkelin potilasversio: http://www.potilaanlaakarilehti.fi/tiedeartikkelit/mds-ndash-monikasvoinen-luuytimen-toimintahairio/#.VDOe0Cl_u4A
- Pohjoismaisen MDS-ryhmän potilasohje (erikseen matalamman ja korkeamman riskin MDS-potilaille) suomeksi käännettynä: http://www.nmds.org
- Alkuinformaatiovideo vastikään sairastuneelle MDS-potilaalle http://minullatodettiin.fi/index.php/work/mds/