Hoito
- Hoidon valintaan vaikuttavat IPSS-luokitus (matalampi tai korkeampi riski), potilaan ikä ja hänen liitännäissairautensa ja yleinen raihnaisuuden (fragiliteetin) aste.
- Mikään lääkehoidoista ei ole kuratiivinen, jonka vuoksi potilaan kanssa tulee puhua hoidon tavoitteista
- Matalamman riskin taudeissa hoidon tavoitteina ovat sytopenioista johtuvien oireiden korjaaminen ja elämänlaadun parantaminen. Ensilinjan hoitona anemiaan käytetään yleensä kasvutekijähoitoa (erytropoietiini +- G-CSF) ja pienellä osalla potilaista immunosuppressiivista hoitoa. Toisen linjan hoitona tulee 5q- -oireyhtymässä harkittavaksi lenalidomidi ja muilla joskus atsasitidiinihoito, joskaan sillä ei ole virallista käyttöaihetta matalamman riskin MDS:ssä. Osalla hoitoresistenteistä potilaista tai etenevässä taudinkuvassa harkitaan allogeenista kantasolujensiirtoa. Tukihoitoja käytetään muiden hoitojen rinnalla, joskus etenkin iäkkäillä yksinomaisena hoitona.
- Korkeamman riskin taudeissa selvitetään heti dg-vaiheessa allogeenisen kantasolujensiirron mahdollisuus huomioiden potilaan ikä ja liitännäissairaudet. Jos siirto ei tule kyseeseen, ensisijainen hoito on atsasitidiini, jota käytetään tarvittaessa myös kantasolujensiirtoa edeltävästi. Joskus käytetään intensiivistä solunsalpaajahoitoa, mutta matala-annoksista solunsalpaajahoitoa nykyään harvemmin. Hoitojen tavoitteena on elossaoloennusteen parantaminen ja leukemisoitumisriskin pienentäminen.
- Ennusteellisesti merkittävien mutaatioiden osoittaminen saattaa tulevaisuudessa osaltaan ohjata hoitovalintaa.
- vastearviossa auttavat International Working Groupin (IWG) kriteerit (tähän sivuston sisäinen linkki suomenkieliseen taulukkoon, tämä kirjallisuuslinkki siirretään taulukon otsikkoon)
1. Matalamman riskin (IPSS Score ≤ 1.0 tai IPSS-R Score ≤ 4.5) hoidot:

1.1 Sytopenioiden tukihoidot
1.1.1 Anemia
- anemiaan liittyy huonontunut elämänlaatu ja suurentunut sydäntapahtumavaara
- punasolujensiirrot oireiseen anemiaan (B-Hb<80-90 g/l) huomioiden se, että ne aiheuttavat rautakuorman kertymistä
- seuranta: B-PVK+T tarpeen mukaan, P-Ferrit ja transfuusiotarpeen rekisteröinti 3 kk välein
1.1.2 Trombosytopenia
- trombosyyttiensiirtoja vain merkittäviin vuotoihin, ei ennaltaehkäisevästi (poikkeuksena toimenpiteet ja MDS:n hoitoihin liittyvät trombosytopeniat)
- traneksaamihaposta voi olla hyötyä vuotojen ehkäisyssä ja hoidossa
- trombopoietiiniagonisteja tutkittu vaihtelevin tuloksin, Cochrane-katsauksessa (Desborough M et al. Cochrane Database Syst Rev 2016:2016) ei riittävää osoitusta romiplostiimin tai eltrombopagin suosittelemiselle
- eltrombopagia (suuremmilla annoksilla kuin ITP:ssä) voidaan harkita matalamman riskin MDS:ssa ongelmallisen trombosytopenian hoidossa, kun Bm-blastit <5%, mutta ei ole virallinen käyttöaihe
1.1.3 Infektiot
- infektioiden nopea ja tehokas hoito on keskeistä
- rutiininomaisesta valkosolukasvutekijäprofylaksista ei hyötyä oireettomalla neutropeniapotilaalla
- käytetään hoidettaessa neutropeenisen potilaan infektioita, toistuvien vakavien infektioiden estohoidossa ja syvän neutropenian estohoitona atsasitidiinia saavilla (joskin neutrofiilitasolla >0,5 infektioita esiintyy harvoin)
- potilaat tulisi rokottaa pneumokokkia ja influenssaa vastaan ja ohjeistaa hyvään käsihygieniaan
1.2 Muut tukihoidot
1.2.1 Raudan kelaatiohoito
Indikaatio:
- jatkuva punasolujensiirtoja vaativa anemia ja
- odotettavissa oleva elinaika >2 vuotta (eli IPSS matalamman riskin tauti) sekä
- P-Ferrit > 1500 µg/l (yleensä noin 25 punasoluyksikön annon jälkeen)
- Maksan MRI T2* -kuvaus valikoiduissa tapauksissa maksan rautavarastojen määrittämiseksi
- allosiirtoon menevillä varhaisessa vaiheessa, jo estämään ennalta rautakuorman kehittymistä
Toteutus:
Deferasiroksi (ensisijainen)
- aloitusannos 5-10 mg/kg kerran päivässä, nosto asteittain ad 20-40 mg/kg/vrk (tyhjään mahaan vähintään 30 min ennen ateriaa)
- ruoansulatuskanavan haittavaikutuksia ja kreatiniinin suurenemista 25%:lle
- kreatiniinin seuranta alkuun viikottain kuukauden ajan, myöhemmin kuukausittain
- jos kreatiniini suurenee ad 2x viitevälin yläraja, tauotus ja jatkossa aloitus pienemmällä annoksella
- lääkkeen ottaminen ruoan kanssa vähentää vatsaoireita ja ripulia
- Novartiksen edustajan mukaan dispergoituva tabletti korvautuu keväästä 2017 lähtien kalvopäällysteisellä nieltävällä kapselilla, jonka GI-siedettävyys on parempi
Desferrioksamiini
- 5-7 tunnin jatkuva infuusio pumpulla ihon alle, 5-7 vrk/viikko
- annos yleensä 20-60 mg/kg/vrk
- C-vitamiinilisä 1 kk hoidon aloituksesta (max 200 mg/vrk), jollei sydämen vajaatoimintaa
Tavoite ja hoitovaste: P-Ferrit-tavoite kelaatiohoidossa on < 1000 µg/l. Korkeaan ferritiiniin on todettu liittyvän lyhentynyt elinaika. Ei kuitenkaan tiedetä, pidentääkö raudan kelaatiohoidolla aikaansaatu plasman ferritiinitason pieneneminen elinaikaa.
1.2.2 Kasvutekijähoito erytropoietiinivalmisteilla
Indikaatio:
- oireinen anemia (Hb < 100 g/l) matalamman riskin raudissa (Bm-blastit <10%), kun muut anemian syyt poissuljettu ja S-EPO < 500 U/l ja/tai punasolujensiirtotarve < 2 yks/kk
Toteutus:
- epoetiini: aloitusannos on 30 000 KY/vk sc (450 KY/kg/vk) . Jos Hb ei suurene vähintään 15 g/l kahdeksassa viikossa, annos kaksinkertaistetaan
- darbepoetiini: yleensä 500 ug sc kolmen viikon välein tai 300 ug kahden viikon välein. Jos Hb ei suurene vähintään 15 g/l kahdeksassa viikossa, tihennetään annostusta ad 300 ug kerran viikossa
- pienipainoisilla tai munuaisten vajaatoiminnassa annokset yleensä pienemmät
- ellei kaksinkertaistetullekaan EPO-annokselle vastetta, hoitoon voidaan harkita liitettäväksi matala-annoksinen G-CSF, esimerkiksi filgrastiimi 12-30 MU (120-300 ug) 2-3 kertaa viikossa sc. Valkosolukasvutekijähoidossa pyritään selkeään neutrofiilinousuun, tasolle 6-10x109/l
- RARS:ssa aloitetaan suoraan EPO + G-CSF -yhdistelmällä (?, tarkistetaan tulossa olevasta pohjoismaisen ohjeen päivityksestä, ohjeistetaanko vielä näin, ELN ei ohjeista)
- seuraa harvakseltaan ferritiiniarvoa: lisää rautalääkitys, jos ferritiini matala tai fP-Trfesat < 20%
- jos Hb suurenee > 120 g/l, pienennetään annoksia tai harvennetaan pistoksia (tarvittaessa tauotus ja uudelleenaloitus 50%:n annoksella, kun Hb <120 g/l)
Hoitovaste:
- korjaa anemiaa noin puolella potilaista, parantaa elämänlaatua, saattaa pidentää elinaikaa, myöhentää transfuusiotarpeen alkamista
- vaste saavutetaan yleensä 12 viikossa, mutta viimeistään 16 viikossa, vasteen keston mediaani noin 2 vuotta
- jos vastetta ei saavuteta (joko punasolusiirtoriippumattomuus tai stabiilissa anemiassa Hb:n suureneminen >15 g/l), hoito lopetetaan tehottomana ja harkitaan luuydinmorfologian tutkimista mahdolisen progression varalta
1.3 Immunosuppressiiviset lääkkeet
Osalla RA- tai RCMD-potilaista sytopenioiden taustan arvellaan olevan immunologinen, samantyyppinen kuin aplastisessa anemiassa.
Indikaatio
- erytropoietiinihoidolle resistentit matalan riskin alle 60 (-70) -vuotiaat potilaat, joilla on vaikea sytopenia, hypoplastinen ydin, ei blastiylimäärää eikä korkean riskin kromosomipoikkeavuuksia
- HLA DR15 -positiivisuus tai PNH-klooni lisäävät vasteen todennäköisyyttä ainakin yli 50-vuotiailla
Toteutus
- antilymfosyyttiglobuliini (ATG) yksin tai yhdessä siklosporiinin kanssa
- aplastisessa anemiassa hevosen ATG (Atgam®) 40 mg/kg/vrk 4 vrk:n ajan tutkitusti tehokkain, mutta MDS:ssa mahdollista antaa vaihtoehtoisesti kanin ATG (Thymoglobuline®) 3,75 mg/kg/pv päivinä 1-5 tai hevosen ATG (Lymphoglobulin®) 15 mg/kg/pv päivinä 1-4
- kombinoidaan siklosporiini 3-5 mg/kg/vrk jaettuna kahteen osaan (B-CyA -tavoite 150-250 µg/l) vähintään 3-6 kk ajan, hoitoon vastaavassa taudissa usein pitkäaikaisena ylläpitohoitona
- seerumitaudin ehkäisemiseksi prednisoloni 1 mg/kg/vrk päivinä 1-10 asteittain päivinä 11-24 purkaen
- iäkkäillä voidaan harkita siklosporiinia monoterapiana ATG:n toksisuuden vuoksi
- pneumokystisprofylaksi 6 kk
- vaihtoehtona ATG:lle voidaan joskus harkita alemtutsumabia 10 mg/pv iv 10 pv (Neukirchen J et al. Ann Hematol 2014;93:65-9)
Hoitovaste antilymfosyyttiglobuliinihoidolle
- vaste 30-50%:lle
- anemian lisäksi myös muissa sytopenioissa korjautumista
- ilmenee keskimäärin 2,5 kuukaudessa, voi tulla vasta 3-6 kk:ssa
- vasteen kesto keskimäärin 3 vuotta
1.4 Lenalidomidi
Indikaatiot
- FDA on hyväksynyt lenalidomidille käyttöindikaation matalamman riskin MDS:ssä, jossa on kromosomipoikkeavuutena 5q- joko yksin tai muiden poikkeavuuksien kanssa
- EMEA on hyväksynyt lenalidomidin punasolusiirtoriippuvaisille pienen tai Int-1-riskiryhmän MDS-potilaille, joilla 5q- on yksittäisenä sytogeneettisena poikkeavuutena, kun muut hoitovaihtoehdot ovat riittämättömiä tai eivät sovi potilaan hoitoon
- jos luuydinbiopsian immunohistokemiassa voimakas tumien p53-värjäytyminen, on AML-progressioriski suurempi, MDS-004-tutkimuksessa 27.5%/2 vuotta (versus 3.6% IHC-p53-negatiivisilla)
- ei korvattavuutta Suomessa MDS-indikaatiolla (vuonna 2016)
Toteutus
- ennen hoitoa tulisi tutkia TP53-geenin mutaatiostatus joko luuydinbiopsian immunohistokemialla tai sekvensoinnilla; mutaatio todetaan 20%:lla MDS 5q- -potilaista, näillä potilailla taudin ennuste huonompi ja lenalidomidivasteet lyhyempiä
- aloitusannos 10 mg/pv päivinä 1-21 (10 mg/pv annos tehokkaampi kuin 5 mg), syklien pituus 28 pv
- annosta pienennettävä munuaisten vajaatoiminnassa
- alkuvaiheen neutro- ja trombosytopenioita n. 50%:lla, esiintyminen ennustaa hyvää hoitovastetta
- kahden ensimmäisen hoitosyklin aikana verenkuvaseuranta viikottain
- tarvittaessa annosreduktioharkinta, G-CSF-harkinta
- rutiininomaista tromboosiprofylaksiaa ei tarvita
Hoitovaste
- 5q- oireyhtymässä 67% punasolujensiirroista riippumattomiksi, 45%:lle täydellinen sytogeneettinen vaste
- vasteen ilmaantumisajan mediaani 4.4 viikkoa, vastearvioon tarvitaan vähintään 3-4 sykliä
- hoitoon vastaavilla hoitoa jatketaan, vasteen kesto keskimäärin 2,2 vuotta
- täydellisessä sytogeneettisessä vasteessa lopettaneilla hoitovaste on voinut säilyä ilman lääkettäkin
- jatkoseuranta: B-PVK+T+Neutrofiilit 3 kk välein, luuytimen hematologinen kromosomitutkimus 6 kk välein
- satunnaistetussa non-5q- MDS-tutkimuksessa 26%:lle potilaista punasolusiirtoriippumattomuus, vasteen mediaanikesto 41 viikkoa (Raza et al. Blood 2008;111:86-93)
1.5 Allogeeninen kantasolujensiirto
Indikaatiot
- < 70-vuotias hyväkuntoinen matalamman riskin potilas, jolla muuhun hoitoon reagoimaton vaikea sytopenia, huonon ennusteen kromosomilöydös tai suureneva ytimen blastiosuus
- IPSS-R-luokitus voi antaa lisätietoa riskistä; sen keskiriskiryhmässä mutaatioanalyysi saattaa lähitulevaisuudessa auttaa siirtoon menevien potilaiden valinnassa (TP53, ASXL1, RUNX1 ja EZH2 liittyvät huonoon ennusteeseen MDS:ssa
- toteutus ja hoidon vaste: kts. korkeamman riskin hoidot: allogeeninen kantasolujensiirto
- konsultoidaan kantasolujensiirtokeskusta
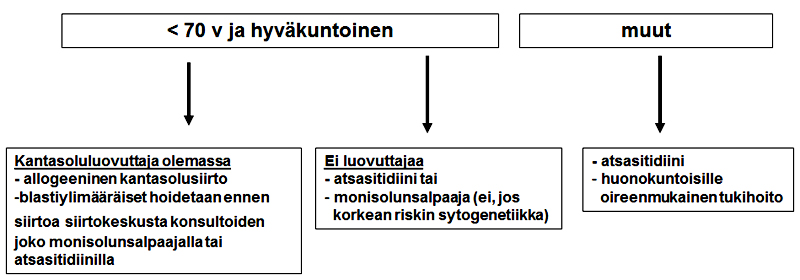
1.6 Atsasitidiini
- kts. indikaatiot korkeamman riskin kohdalta
- voidaan harkita, jos EPO-hoito ja/tai immunosuppressiivinen hoito eivät tehoa tai tule kyseeseen eikä potilas sovellu allogeeniseen kantasolujensiirtoon (kts. siirtoindikaatiot kohdasta Allogeeninen kantasolujensiirto) etenkin jos potilaalla on vaikea sytopenia tai korkean riskin kromosomilöydös tai blastiylimäärä lisääntyy
- annos vakioannos 75 mg/m2 sc seitsemän pv ajan 28 pv:n sykleissä, myös 5 vrk:n annostelua voi harkita (Lyons RM et al. JCO 2009)
- EPO-resistenteillä 40-50%:lle vaste anemiaan; elinaikahyötyä ei ole toistaiseksi osoitettu
2. Korkeamman riskin (IPSS >/= 1,5 tai IPSS-R >/=4,5) hoidot:
2.1 Hypometyloivat hoidot
2.1.1 Atsasitidiini
- hypometyloiva lääke, joka indusoi kasvuun, erilaistumiseen ja apoptoosiin liittyviä geenejä
- ei paranna MDS:aa, mutta hidastaa sen kulkua
- korkeamman riskin taudissa ensilinjan hoito nillä, joilla ei suoraan edetä kantasolujensiirtoon
- ainoa lääke, jolla on faasin III tutkimuksessa osoitettu elinajan piteneminen MDS:ssa verrattuna tukihoitoon, matala-annoksiseen solunsalpaajahoitoon tai intensiiviseen solunsalpaajahoitoon
Indikaatio
- FDA hyväksynyt käyttöaiheeksi matalamman ja korkeamman riskin MDS:n, mutta EMEA ainoastaan korkeamman riskin MDS:n (ja AML:n)
- voidaan käyttää myös ennen allogeenista kantasolujensiirtoa pienentämään ytimen korkeaa blastiosuutta, etenkin potilailla, joilla on korkean riskin kromosomipoikkeavuus (ei ole virallinen indikaatio)
- 75 mg/m2/vrk sc 7 pv kuurein, syklin pituus 28 vrk
- epävirallisesti käytetään myös annostelua 75mg/m2/vrk päiväaikataululla 5-0-2 (=viikonlopputauko) tai 100 mg/m2/vrk 5 vuorokauden ajan, mutta näiden annostelutapojen tehosta ei ole vertailua vakioannostukseen
- vaste tulee hitaasti, suositellaan (4)-6 hoitojaksoa ennen vastearviota luuytimestä
- vasteista 50% saavutetaan kolmen, 80% kuuden ja 90% yhdeksän syklin jälkeen
- jos saavutetaan vaste, hoitoa suositellaan jatkettavaksi tautiprogressioon saakka
- haittavaikutuksia eniten kahden ensimmäisen syklin aikana
- myelosuppressio, pahoinvointi, GI-oireet, injektiokohdan ärsytys (lievitettävissä helokkiöljyllä tai tulehduskipulääkegeelillä)
- verenkuvakontrolli viikoittain 3 ensimmäisen syklin aikana, sen jälkeen 2 vk välein
- alkuvaiheen sytopenioista huolimatta ei annosreduktioita eikä mielellään myöskään hoitovälien pidennyksiä kolmen ensimmäisen syklin aikana, etenkään edenneessä MDS:ssa
- myöhempien sytopenioiden yhteydessä luuydintutkimus: jos myelosuppressiota ilman viitteitä tautiprogressiosta, annosreduktio esim. ad 50 mg/m2/vrk tai hoitoväli 5 viikkoon
Vaste
- 50%:lla hoitovaste, jonka kesto keskimäärin 13,6 kk
- punasolujen siirtotarve lakkaa 45%:lla
- trombosyyttiluvut korjautuvat 20-30%:lla
- CR- ja PR -vasteita 11-29%:lla
- pidensi elinaikaa faasin III tutkimuksessa 9,5 kk
- kaikentyyppiset hoitovasteet assosioituivat elinaikaetuun
- taudin leukemisoituminen hidastui
- vaste ei riippunut potilaan iästä (myös >75-vuotiaat hyötyivät), FAB/WHO -tyypistä, ytimen blastimäärästä tai karyotyypistä (myös -7/del7q -potilaat vastasivat hoidolle)
- haittavaikutukset kohtuullisen vähäisiä ja infektioita < 20%:lla
- vaste menetetään puolella potilaista 1-1,5 v kuluessa
- kun tauti etenee/relapsoituu, ennuste huono (keskimäärin vain 6.5 kk)
- progressioon/relapsiin ei tällä hetkellä hyviä hoitovaihtoehtoja
2.1.2 Desitabiini
- vasteet samanlaisia kuin atsasitidiinilla korkeamman riskin taudissa, mutta elinaikaetua ei ole osoitettu
- FDA hyväksynyt MDS-indikaatiolla; EMEA ainoastaan AML-indikaatiolla
- annos 20 mg/m2 5 pv (20 mg/m2 10 pv:n annostuksella saatu hyviä vasteita korkean riskin kromosomi- ja TP53-muutoksissa)
- vaihto atsasitidiinista desitabiiniin harvoin hyödyllistä
2.2 Intensiivinen solunsalpaajahoito
- yleisimmin antrasykliini-AraC -yhdistelmä (sytarabiini joko jatkuvana tai kahdesti päivässä)
Indikaatio
- <65-vuotiaille korkeamman riskin potilaille
- vastetta ennustavat: B-Leuk <4x109/l, ei-korkean riskin kromosomilöydös ja normaali LD
- harkitaan, jos atsasitidiinihoidolle ei saada vastetta (korkean riskin kromosomilöydöspotilaat eivät kuitenkaan hyödy)
- voidaan käyttää ennen allogeenista kantasolujensiirtoa pienentämään ytimen blastiosuutta
- pitkittyneen luuydinlaman vaara, hoidon mortaliteetti 10-20%
Hoitovaste
- CR 40-60%, kesto 10-12 kk
- 10%:lle pitkäaikainen CR (nuoria potilaita, joilla normaali karyotyyppi)
- ei elinaikahyötyä, ellei päästä CR-tilanteeseen ja sen jälkeen allogeeniseen kantasolujensiirtoon
2.3 Matala-annoksinen solunsalpaaja
- harkitaan allogeenisen kantasolujensiirron ulkopuolella oleville korkeamman riskin taudissa, jos atsasitidiiniä tai monisolunsalpaajahoitoa ei voi käyttää
- ei vaikutusta elinaikaan tai leukemisoitumisaikaan
- vasteet lyhyitä
Matala-annoksinen Ara-C
- annos 20mg/m2/pv sc 14-21 pv, kuukauden välein
- hoitovasteet: CR 15-20%, PR 15-20% (korkean riskin kromosomilöydös huonontaa vastetta)
- ei elinaikaetua
2.4 Allogeeninen kantasolujensiirto
Indikaatio
- <70-vuotias korkeamman riskin potilas, jolla ei ole merkittävää komorbiditeettia
- alle 50-vuotiailla tai luuytimenvajaatoimintaoireyhtymän fenotyypin tai viitteellisen sukuanamneesin yhteydessä tulisi poissulkea periytyvät MDS-alttiudet ja telomeropatiat, koska ne vaikuttavat mahdollisen sisarusluovuttajan valintaan ja siirron esihoitoon
- kantasolujensiirtokeskuksen konsultaatio
- päivitetty kantasolujensiirto-riskiluokitus (Sorror ML, Blood 2013); netissä on linkki siihen pohjautuvaan riskilaskuriin: http://www.hctci.org/
Toteutus
- nuoremmille potilaille täysimittainen esihoito
- vanhemmille potilaille tai niille, joilla on merkittäviä oheissairauksia, kevennetty esihoito, esimerkiksi treosulfaanipohjainen
- jos ytimen blastiosuus >10%, ennen siirtoa intensiivinen solunsalpaajahoito tai atsasitidiini
Hoitovaste
- keskimäärin 35-40% pitkäaikaiseen remissioon
- sytogenetiikka ja ytimen blastiosuus tärkeimmät relapsiriskiä ennustavat tekijät
- pitkäaikaistulokset (OS) selvästi paremmat matalamman riskin MDS:ssa (IPSS-Low 75%, IPSS-Int-1 60%) kuin korkeamman riskin taudissa (IPSS-Int-2 45% ja IPSS-High 30%)
- kompleksisessa karyotyypissä ja sekundaarisessa MDS:ssa ennuste siirrollakin huono (10%)
- toimenpidemortaliteetti 15-25% ja relapsiriski 20-30% (relapsi yleensä kolmen vuoden sisällä)
2.5 Tutkimuksissa olevia hoitoja
2.5.1 Hypometyloivat lääkkeet
Atsasitidiini
- matalamman riskin MDS:ssa
- allogeenisen kantasolujensiirron jälkeisessä relapsissa
- ylläpitohoidossa kemoterapian jälkeen
- per os -annostelu
- tutkimuksia useissa kombinaatioissa, mm.:
- atsasitidiini + lenalidomidi
- atsasitidiini + histonideasetylaation estäjä
- atsasitidiini + anti-PD-1
Guadesitabiini, SGI-110
- korkeamman riskin taudissa
- puoliintumisaika 4,5 kertaa pitempi kuin desitabiinilla
2.5.2 Immunomoduloivat lääkkeet
Lenalidomidi
- matalamman riskin ei-5q- -MDS-potilailla
- neljäsosalla punasolusiirtotarve lakkaa
- vähemmän hoitotoksisuutta kuin 5q- -oireyhtymää hoidettaessa
- erytropoietiini + lenalidomidi: punasolujensiirtotarvevasteet lisääntyivät 25%:sta 40%:iin
- korkeamman riskin MDS:ssa
- korkea blastimäärä, trombosyytit <50 ja kompleksinen karyotyyppi ennustavat huonoa vastetta
2.5.3 Kinaasi-inhibiittorit
Rigosertibi (polo-like kinaasi- (PLK) ja PI3-kinaasi-inhibiittori)
- tutkimuksia etenkin hypometyloivan lääkkeen jälkeisessä relapsissa ja korkean riskin sytogenetiikan omaavilla potilailla
Volasertibi (polo-like kinaasi-inhibiittori)
2.5.4 TGF-ß -antagonistit
Luspatersepti
- matalamman riskin taudissa
- inhiboi Smad2/3 -signalointia ja edistää kypsien punasolujen vapautumista verenkiertoon
- punasoluvaste 40%:lla, RA-MDS:ssa (SF3B1-mutaatio+) 67%:lla
- annostelu subkutaanisina pistoksina kolmen viikon välein
Sotatersepti
- vasteet kuten luspaterseptilla
2.5.5 Solunsalpaajat
Klofarabiini ja sapasitabiini (po nukelosidianalogit)
- korkeamman riskin MDS:ssa vasteita 40-50%.lle
2.5.6 Muut
Imetelstaatti (telomeraasi-inhibiittori)
- matalamman riskin taudin anemiassa
Eksatiostaatti (GSTP-1 -inhibiittori)
- matalamman riskin taudissa
- Printer-friendly version
- Log in or register to post comments
